伴随着我国经济发展以及人们的生活方式转变,我国现有糖尿病肾病(diabetickidneydisease,DKD)患者已达2400万,且在未来5年内,DKD患者在相关并发疾病上花费将达1.48亿。根据美国运动医学院声明,全球约4.63亿人患糖尿病(diabetes mellitus, DM),且有20%~40%的DM患者可发展为DKD。在世界范围内,DKD不仅是慢性肾脏病(chronic kidney disease, CKD)以及终末期肾病(end-stage kidney disease, ESKD)的首要病因,而且还是心血管疾病的独立危险因素,同时DKD患者的心脑血管疾病发病率和早发死亡率是没有罹患DKD患者的20~40倍。
DM作为全身代谢性疾病,可分为1型糖尿病(type 1 diabetes mellitus, T1DM)和2型糖尿病(type 2 diabetes mellitus, T2DM),而在DM发病中T2DM比较常见;在T2DM情况下,肾脏代谢和血流动力学的紊乱及其相互作用促进了DKD的病程发展。从DKD发病机制来看,主要以血糖稳态失衡、肾脏氧化应激与炎症加重、肾素–血管紧张素–醛固酮系统(rein-angiotensin-aldosterone system,RAAS)失调为主;从临床病理角度看,DKD导致了肾小球肥大、基底膜增厚、系膜增生、间质纤维化等。当下药物治疗DKD带来的不良影响会导致部分DKD患者出现低血糖症、低血钾症以及并发急性胰腺炎等;而运动作为非药物干预治疗方法,不仅可以从调控血糖稳态、减轻肾脏的氧化应激与炎症反应、调节RAAS功能等方面去改善DKD,还可以恢复肾小球、基底膜功能,减少间质纤维化等(图1)。
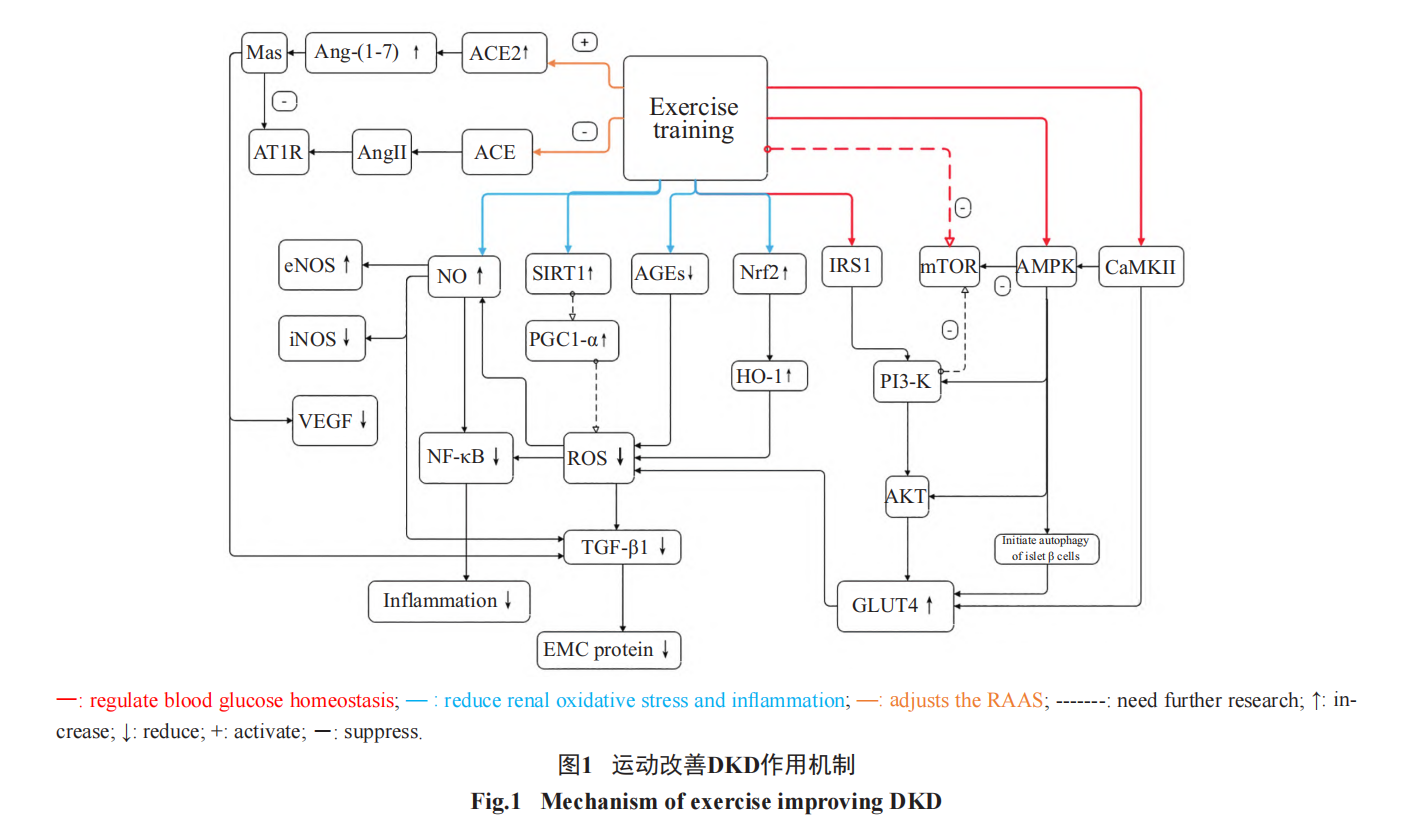
因此,本文将对运动干预DKD的作用机制进行综述,以期为后续临床干预DKD提供研究思路。
1 运动与血糖稳态
1.1 T2DM与血糖稳态
T2DM是胰岛素分泌减少、胰岛素抵抗增加、胰高血糖素代谢紊乱等导致的以高血糖为特征的进行性疾病,而机体持续的高糖环境,又会使机体并发DKD。胰岛素底物受体(insulin receptor substrate, IRS)作为胰岛素信号转导的关键介质,其可以促进骨骼肌对葡萄糖的摄取;较早的研究证明,当IRS1被敲除时,小鼠出现外周胰岛素抵抗与生长发育迟缓,当IRS2被敲除时,小鼠的肝脏、骨骼肌、脂肪不仅出现代谢缺陷,其胰岛β细胞也会出现凋亡。同时,当机体能量代谢传感器AMP活化蛋白激酶(AMP-activated protein kinase, AMPK)在骨骼肌中被激活后,其还可使骨骼肌中葡萄糖转运蛋白4(glucose transporter 4, GLUT4)从胞内池转移到细胞膜,让血液中的葡萄糖进入细胞;而JIANG等指出在高糖状态下,AMPK和肝激酶B1(liver kinase B1, LKB1)将会发生解离。此外SUNG等指出在高脂喂养的肥胖小鼠的骨骼肌中,活化的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)会使下游S6K1介导的胰岛素信号被抑制,IRS1、IRS2降解,从而导致骨骼肌葡萄糖摄取量减少以及糖原积累;同时WILLIAMSON等也指出T2DM患者骨骼肌中S6K1的磷酸化程度更高。因此,IRS1、IRS2对血糖稳态的维持至关重要,而在高糖状态下,AMPK蛋白含量是降低的、信号通路是被抑制的;mTOR蛋白含量则是升高的、信号通路是被激活的。
1.2 运动调控血糖稳态
1.2.1 运动调控IRS1/PI3-K/AKT/GLUT4通路改善血糖稳态
研究发现,10周的有氧运动可使胰岛素抵抗大鼠的IRS1蛋白表达量增加;同时KIRWAN等指出,进行周期性的有氧运动对人体骨骼肌中的IRS1相关的磷脂酰肌醇3-激酶(phosphatidylinosito l3-kinase,PI3-K)的激活程度更高,并可促进骨骼肌中GLUT4对葡萄糖的摄取。此外,付颖等证明,DM大鼠进行中等强度有氧运动后,不但IRS2蛋白含量、GLUT4蛋白含量、IRS2磷酸化程度增加,且GLUT4蛋白含量和IRS2磷酸化增长效应可持续48h。同时,曾雨也在研究中指出有氧运动可通过IRS1/PI3-K/AKT/GLUT4去改善胰岛素抵抗。故运动可以通过IRS1/PI3-K/AKT/GLUT4去改善外周胰岛素抵抗。
1.2.2 运动调控AMPK通路改善血糖稳态
王孝强等研究指出,有氧运动虽不能让胰岛素抵抗大鼠胰岛β细胞中LKB1/AMPK信号出现显著改变,但可以让大鼠LKB1、AMPK蛋白水平有上升的趋势;同时杨坡等还认为运动可以激活AMPK及其上游复合物自噬启动因子1(UNC51-likekinase1,ULK1),而活化后具有酶活性的ULK1通过磷酸化自噬蛋白ATG13和FIP200,也可以改善胰岛β细胞的功能。另刘倩雯等对DKD患者进行负荷量70%~80%的抗阻运动后,DKD患者血糖、糖化血红蛋白、血肌酐等水平显著下降。因此,运动不仅使LKB1、AMPK含量上升,也可以通过平衡胰岛β细胞的自噬去调控机体血糖。
1.2.3 运动调控CaMKII通路改善血糖稳态
骨骼肌的收缩可以使细胞Ca2+浓度升高、钙调蛋白复合体的数量增加;而在与Ca2+相关的钙调蛋白信号通路中,钙调蛋白依赖的蛋白激酶II(calmodulin-depen-dent protein kinaseII, CaMKII)也是骨骼肌摄取葡萄糖的重要分子。同时WITCZAK等指出,在抑制CaMKII基因表达的骨骼肌中,虽然CaMK活性降低了35%,葡萄糖摄取量降低了30%,但GLUT4蛋白含量没有改变且AMPK磷酸化程度显著增加。SMITH等指出有氧运动可以让大鼠CaMKII在骨骼肌肌纤维核周磷酸化程度增加,GLUT4mRNA含量增加2.2倍,蛋白含量增加1.8倍。同时COMBES等证实,在高强度间歇训练(high intensity interval training, HIIT)后检测健康受试者股外侧肌中的AMPK、CaMKII,其磷酸化的程度相比于静息时增加了2.9、2.7倍,而在3h后再次检测,AMPK、CaMKII的磷酸化水平均未增加。因此,运动需要达到一定强度才能更好地激活CaMKII,而CaMKII、AMPK在调控机体血糖机制方面可能存在一定的重叠。
1.2.4 运动调控mTOR通路改善血糖稳态
使用mTOR抑制剂可以在抑制mTOR通路的同时使机体发生抗炎、抗增殖、自噬启动等;而当机体处于疾病状态时,mTOR一般处于激活状态。在刘霞等研究中,高脂膳食组mTOR、S6K1mRNA表达量上升,而有氧运动可使两者表达量下降且使PI3K、AMPK蛋白量增加。但张杰指出有氧与抗阻运动可以使正常大鼠mTOR的磷酸化程度增加且抗阻运动比有氧运动磷酸化程度更高。同时较早的研究也证明,运动后健康受试者的运动腿和非运动腿mTOR的磷酸化水平提高了45%~65%,且AMPK的磷酸化水平也增加了40%。因此,在疾病状态下,运动可以提升AMPK活性从而抑制mTOR活性,进而使机体产生抗炎、抗增殖、自噬启动等反应;而在机体健康状态下运动使mTOR磷酸化水平提高,则可能是某种代谢所需。
综上所述,运动可以通过IRS1/GLUT4、AMPK、CaMKII、mTOR通路去调节骨骼肌对葡萄糖的吸收,从而去改善外周胰岛素抵抗,进而使血糖达到稳态以延缓DKD的病程。同时上述通路与通路间又是相互联系、相互作用的。
2 运动与肾脏氧化应激与炎症
2.1 DKD与肾脏氧化应激与炎症
线粒体不仅在能量与活性氧(reactive oxygen species, ROS)的产生、线粒体自我增殖、线粒体分化等过程中起关键作用,而且还调节其他细胞的增殖、分化、炎症等。经高糖处理的小鼠肾小球内皮细胞呼吸储备能力显著降低,且与正常小鼠对比DM小鼠肾脏线粒体ROS增加、肾足细胞有丝分裂功能受损;同时ZHOU等指出经高糖处理后的肾足细胞中沉默信息调节因子2相关酶1(silence information regulator 1, Sirt1)mRNA水平降低,且当DM小鼠肾脏颗粒蛋白前体(progranulin,PGRN)基因被敲除时,Sirt1基因表达水平降低、PGC-1α乙酰化水平显著升高。另在DKD的情况下,肾脏中内质网蛋白错误折叠还会影响其蛋白表达以及糖基化过程,从而使机体蛋白尿排泄、肾脏炎性反应增加;此外,内质网也可通过一氧化氮合酶(nitric oxide synthase, NOS)解耦反应产生一定量的ROS。
对于DKD来说,肾小球内皮细胞(glomerular endothelial cells, GECs)功能障碍是DKD的早期表现,后持续的高血糖以及肾脏不断增加的ROS,可以使肾脏NOS基因表达被抑制,一氧化氮(nitric oxide, NO)水平减少;同时晚期糖基化终末产物(advanced glycation end products, AGEs)也会不断聚集且与肾脏中胶原等进行共价结合,这不但会导致肾小球基底膜增厚且可诱导系膜细胞合成更多的细胞外基质(extracellular matrix, ECM),还可以激活核因子κB(nuclear factorkappa-B, NF-κB)、PI3K/AKT/mTOR等通路降低抗氧化酶、谷胱甘肽、NOS的水平;此外,部分葡萄糖也可以通过多元醇途径生成更多的果糖与还原型辅酶I(reduced coenzymeI, NADH),而不断增加的NADH不仅可以通过线粒体电子呼吸链产生更多的ROS,还可以通过糖酵解途径、三羧酸循环途径产生更多的甘油二酯;而持续的高血糖以及甘油二酯又可以激活蛋白激酶C(protein kinaseC, PKC)通路,活化后的PKC通路不仅可以抑制NOS基因的表达,还可以激活NF-κB通路。同时YUNG等在DM小鼠肾小管间质中不仅观察到PKCmRNA增加,也观察到转化生长因子-β1(transforming growth factor-β1, TGF-β1)与纤维连接蛋白I、纤维连接蛋白III、纤维连接蛋白IV型的胶原蛋白的mRNA增加。
综上所述,DKD肾脏氧化应激与炎症的发生是多种因素共同作用的结果;其中肾脏线粒体功能障碍、肾内皮细胞功能障碍、AGEs聚集、多元醇途径的激活、PKC途径的激活又是导致肾脏氧化应激与炎症的主要原因,而在这几方面的相互影响、相互作用的情况下,又可以引起肾脏相关结构功能丧失与相关细胞的凋亡。基于此,DKD将会向更差的方向发展。
2.2 运动减轻肾脏氧化应激与炎症
RODRIGUES等证实,8周的有氧运动不仅让DM肥胖大鼠肾皮质脂质过氧化水平降低,还可以让其肾脏NO、诱导型一氧化氮合酶(inducible nitric oxide synthase, eNOS)水平提高,内皮型一氧化氮合酶(endothelial nitric oxide synthase, iNOS)水平降低。同时王莎莎在研究中运用易筋经联合弹力带进行抗阻训练可以使超重或肥胖的患者肾窦脂肪面积下降,且在第6个月时效果最显著。另SOUZA等证明,中等强度的有氧运动可以使DM小鼠肾小球中巨噬细胞、淋巴细胞数量减少,NF-κB的基因表达水平减少,肾间质中TGF-β1mRNA表达水平减少;此外LIU等也观察到有氧运动可以上调DM小鼠肾脏SIRT1基因的表达水平以及抑制NF-κB乙酰化;同时在刘晓晨等的研究中,有氧运动在降低DKD小鼠肾脏ROS水平、增加总超氧化物歧化酶活性的同时,也可以通过Nrf2/HO-1通路使核转录NF-E2相关因子2(nuclear factorery throid-related factor2, Nrf2)蛋白量、近端小管中血红素氧合酶(heme oxygenase-1, HO-1)的蛋白量增加。另在临床应用中,张贝妮采用1周3次的下肢功率自行车对透析患者进行抗阻运动4周,可使其血清丙二醛(malondialdehyde, MDA)水平下降,且在继续进行运动至16周后,血清MDA水平将显著下降。相反ABREU等对CKD患者进行的3个月抗阻运动中,患者虽Nrf2mRNA、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)mRNA表达水平增加,但NF-κB表达水平却无明显变化。同时,陈丽娜等对健康大鼠进行力竭抗阻运动后观察到大鼠尿酸、ROS、iNOS蛋白等水平均显著高于对照组,且伴随肾小球体积增大、基底膜增厚、系膜基质增生。
综上所述,运动对DKD肾脏氧化应激与炎症的干预是通过激活SIRT1/NF-κB、Nrf2/NF-κB、Nrf2/HO-1通路以及上调抗氧化酶活性、增加NO合成等来实现的;而抗阻运动虽然可以使Nrf2、GPS-Px表达水平增加,但其对DKD具体作用通路还未被阐明且抗阻运动是否适用于临床联合干预以及如何规划运动量等均需进一步研究。
3 运动与RAAS
3.1 DKD与RAAS
RAAS在人体内广泛分布,其通过调节水、电解质、循环血压的平衡来维持机体血流动力的稳定。同时RAAS又由两个轴,即升压轴与降压轴组成。在升压轴中,肾素可以使血管紧张素原转化为血管紧张素I(AngI),而AngI在血管紧张素转换酶(angiotensin converting enzyme, ACE)的作用下又可转化为AngII;作为升压轴的主要效应物AngII,其作用于AngII型受体1(Ang type II receptor 1, AT1R)可使机体小微动脉收缩,促进肾脏水、钠重吸收以及醛固酮的释放。对于降压轴来说,则是由ACE2、内源性七肽[Ang-(1-7)]、AT2R、Mas受体构成的。在DKD中,RAAS升压轴会被持续激活,使入球小球脉、肾小球压力增加,AngII、ROS产生增多,导致ECM增加、系膜细胞产生更多的TGF-β1,从而导致肾小球硬化与纤维化。而在LIU等研究中,DM大鼠经ACE2基因转染后,大鼠的血压、尿蛋白排泄量、肾脏硬化指数均降低,TGF-β1与血管内皮生长因子(vascular endothelial growth factor, VEGF)mRNA表达下调的同时,还伴随着超氧化物歧化酶活性增加、Ang-(1-7)浓度增加、足细胞相关蛋白Nephrin含量上升。因此,在DKD的情况下,RAAS升压轴被过度激活且肾脏AngII及其介导的下游成分含量是升高的,而降压轴与肾脏ACE2及其介导的下游成分则是被抑制的。
RAAS不仅可以通过影响小动脉平滑肌直接发挥升血压作用,还可通过刺激醛固酮的产生来间接发挥升血压作用;同时AngII也可以作用于肾上腺皮质球状带来促进醛固酮的合成。XUE等指出,DM大鼠肾脏的醛固酮合成酶mRNA表达水平是对照组大鼠的12倍,而在使用AT1R拮抗剂后,肾脏醛固酮合成酶的mRNA表达水平显著下降。此外,XUE等的另一份报告中指出,双肾上腺切除的DM大鼠虽血糖、肾脏醛固酮含量升高,但其血浆醛固酮含量降低,且在使用醛固酮合成酶抑制剂后,DM大鼠除了血糖水平无变化外,其肾脏醛固酮含量、NF-κB、TGF-β1蛋白含量均降低。因此,在DKD情况下,全身醛固酮系统可以参与局部醛固酮系统的调节,而肾脏局部醛固酮含量的升高又可以加重肾脏炎性反应,进一步促进DKD的发展。
3.2 运动调节RAAS
研究表明,运动在激活ACE2/Ang-(1-7)/Mas轴的同时可以抑制ACE/AngII/AT1R轴。MAGAL-HÃES等也指出,健康受试者在运动后不仅可以使尿AngII含量维持在较低水平,还可以使Ang-(1-7)的含量增加。同时SOMINENI等指出,有氧运动以及有氧运动联合二甲双胍干预DM小鼠在第2周时可以使尿ACE2表达水平降低且在第10周时还可使尿ACE2表达水平持续降低;此外,与对照组相比,运动也可以让DM小鼠肾小球ACE2表达水平增加。同时,在GUO等4年的追踪调查中,日常生活活动较少的DM患者肾小球滤过率、血肌酐水平、糖化血红蛋白水平等会增加,而进行中等强度的日常生活活动则可以降低以上代谢水平,从而减少其对肾脏的不利影响。另陈国志等指出肥胖大鼠血清醛固酮水平显著高于空白组,而通过运动干预后,肥胖大鼠血清醛固酮水平显著降低。相反,在杨玲等研究中,95%耗氧运动则可以让健康受试者血清醛固酮浓度明显上升、血清AngII浓度上升,而低于75%耗氧运动组二者差别与安静组相比虽有上升趋势,但不显著。此外,刘传芝等证明早期DKD患者进行爬楼运动,将导致尿微量白蛋白、尿转铁蛋白免疫球蛋白等排泄加重。
综上所述,在DKD情况下,运动可以激活RAAS中ACE2/Ang-(1-7)/Mas轴使入球小球脉、肾小球压力减小,AngII、ROS、ECM、TGF-β1产生减少,从而减轻肾脏炎性反应以及肾小球硬化与纤维化程度。同时,在运动后,升压轴调控的醛固酮产生量则会减少;而对于健康个体来说,运动后血清醛固酮的增加则是有利于体液中Na+被重吸收以及维持循环血量的平衡;此外,强度过大运动也会造成RAAS的失衡。
4 小结
DKD是由DM引起的CKD,且其发病的主要机制为机体持续高糖环境下肾脏代谢与血流动力学的紊乱;尽管运动可以从改善血糖稳态、减轻肾脏氧化应激与炎症、调节RAAS方面去干预来延缓DKD的疾病进程,但运动对其具体作用机制及通路均需更深入的研究。同时DKD在临床的诊断中有明确的病程分期,而运动干预的方式与之联系研究却还不足,也需进一步深入研究。此外,由于DKD是心血管疾病的高危因素,因此在运动前应该进行运动负荷实验,确保适合自身的运动负荷。最后,根据国内外研究来看,中低强度的运动似乎更适合DKD患者。
参考文献:略
作者:郭宗承 蓝天 马路遥 王灏 何恩鹏
单位:新疆师范大学体育学院运动人体科学重点实验室
来源: 中国细胞生物学学报
声明:
1.本网站所有内容,凡是注明 “来源:心脏康复网”的文字、图片和音视频资料,授权转载时须请注明“来源:心脏康复网”。
2.本网所有转载文章系出于学术分享的目的,版权归原作者所有。如有侵权,请及时联系我们更改或删除。