CPET的重要性已经逐渐被人们所认识,其临床应用包括运动不耐受的诊断和鉴别诊断、心肺疾病严重程度评价与危险分层、运动处方制订与康复指导、医疗干预效果评价以及外科术前风险评估等,具有重要的临床价值[12, 13]。
运动时外呼吸和细胞呼吸的耦联涉及血液、外周循环、心脏、肺脏、肌肉能量代谢途径等多个环节,任何单独或共同环节的功能障碍都会引起运动不耐受。由于不同环节的障碍可以以不同方式影响通气及气体交换,因此,通过对运动过程中获得的气体数据进行分析,系统评价运动中的肺通气与换气、细胞能量代谢及血液动力学的状况,能够较准确地阐明运动不耐受的原因[14, 15]。对于不易通过其他检查获得准确诊断的某些运动不耐受疾病或难以辨别成因的某些症状,如无症状性心肌缺血、舒张功能障碍引起的慢性心力衰竭、无明显肺动脉高压的肺血管栓塞性疾病、卵圆孔未闭导致运动中出现的右向左分流以及心原性呼吸困难等,CPET具有独特的诊断价值[16-18]。目前慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的诊断主要依靠症状及静态肺功能检测,CPET则可进一步评价运动状态下的心肺功能状态。美国医学会(American Medical Association,AMA)在肺功能分级标准中,根据CPET测定的峰值摄氧量(peakVO2)制定了心肺功能诊断标准,按照peakVO2≥25、≥20~<25、≥15~<20、<15 ml·min-1·kg-1,将心肺功能由好至差分为4级[19]。在慢性心力衰竭严重程度分级中,纽约心脏病协会(New York Heart Association,NYHA)分级主要根据患者不同活动水平时的症状分为4级(Ⅰ~Ⅳ级)。Matsumura等[20]发现NYHA分级与peakVO2和无氧阈(anaerobic threshold,AT)相关性良好,表明心力衰竭症状与机体运送氧的能力密切相关。相较于NYHA分级的主观局限性,Weber和Janicki[21]提出一种基于peakVO2和AT的更客观的心功能评价方法(表1)。多数学者认为,与NYHA分级或左心室射血分数相比,peakVO2和AT是更可靠的、独立预测心力衰竭患者生存的指标[22-24]。
CPET被认为是评估心肺储备能力的金标准,对有氧运动处方制订有重要的指导价值。同时,CPET有助于发现运动所诱发的病理生理变化,提高运动安全性[25]。应用CPET制订运动处方,首先要根据CPET测定的相关指标和临床情况,对受试者进行危险分层,根据分层结果确定运动强度的安全范围以及运动时间和运动频率,再根据peakVO2、AT、峰值心率、峰值负荷等指标,制订个体化的运动处方,以确保运动治疗的安全性和有效性。运动强度可以采用peakVO2百分比、最大心率(HRmax)百分比,以及心率储备[heart rate reserve,HRR,HRR=HRmax-静息心率(HRrest)]百分比等表示,也可以采用功率(W)、代谢当量(metabolic equivalent,MET)、km/h等表示。在运动处方实施过程中,要同时结合Borg自我感觉劳累程度分级、心肌缺血阈值等进行调整,特别是对于服用β受体阻滞剂、心脏起搏器置入、心脏再同步化治疗以及心房颤动的患者[2,26, 27]。四、医疗干预效果评价
心脏和外周循环、肺通气与换气的主要作用都是支持细胞呼吸。因此,运动时呼吸反应的测定可提供对这些器官系统功能的最直接而全面的评估。严格实施CPET质量控制可保证有氧运动能力参数(如peakVO2和AT)、随功率变化的心血管和肺通气与换气功能以及能量代谢等指标具有高度可重复性[17],为临床医师提供评估疾病严重程度和医疗干预效果等所需的可重复的客观信息,以便根据病情变化及医疗干预效果,调整治疗方案。
五、外科术前风险评估
围手术期的风险评估已成为十分重要的临床问题。患者运动过程中氧传输提升的能力与术后各器官系统维持功能的能力密切相关,从而可以评估外科手术预后。术前通过CPET测定peakVO2和AT,对于确定高风险手术患者,包括在静息状态时通过临床评估和检查被判定为心肺功能正常的患者以及可能患有未知心肺疾病的老年患者,均能提供有价值的临床依据。
根据不同的临床应用目的,CPET可选择低水平、症状限制、亚极量运动试验等几种方案。CPET实施过程中的风险管控十分重要。为预防运动诱发的心血管不良事件等风险,本共识对CPET提出以下禁忌证(表2)[27, 28]。
1.测试环境:测试房间一般不应小于20 m2,可容纳试验需用的各类检查设备(包括急救设备及药品),同时应保证通畅的急救通道以及应急出口。房间应具有良好的采光和通风,一般温度控制在20~22 ℃,相对湿度50%左右。应注意人性化的环境布置和保护患者隐私。为了便于评估患者的主观努力程度,应在室内墙面上悬挂大小适中的Borg自我感觉劳累程度分级表[27,29]。2.气体定标:鉴于气体分析器和流量表易于偏移,测试前需对气体流速传感器、测定氧气和二氧化碳浓度的气体分析仪定标。如果静态肺功能测试有弥散功能检查的需要,测试前还需对弥散检查的气体进行定标。3.受试者的准备:受试者应病情稳定,近期无治疗药物的调整,穿着舒适衣物,鞋类应适于走路和蹬踏,餐后2~3 h测试为宜。测试前2 h内应避免剧烈活动、吸烟、饮用咖啡、茶、酒等刺激性饮料。测试开始前,应安排受试者试戴面罩(口件)和鼻夹,熟悉Borg自我感觉劳累程度分级表。4.测试者的准备:测试人员应经过专业培训,有熟练的CPET操作技能,能良好应对测试过程中的紧急情况,按照应急流程对患者进行基础及高级生命支持。1.申请试验:首先要排除测试禁忌证。提供受试者的一般信息,并重点说明初步诊断、测试原因、申请试验种类和特殊需要等。2.医师评估:详细了解受试者的现病史、既往史、家族史等。重点关注受试者目前用药情况、吸烟、日常活动水平,有无不稳定性心绞痛、未控制的高血压、严重心律失常或其他运动诱发的症状,以及肺、外周动脉、肌肉骨骼系统等有无可能限制运动的疾病史。3.履行告知义务:试验前必须签署书面知情同意书,内容包括告知患者CPET试验目的、实施过程、注意事项、提醒与运动有关的潜在不适和风险,并鼓励受试者试验前提出相关问题。4.静态肺功能测定:要求获得用力肺活量(forced vital capacity,FVC)、最大自主通气量(maximal voluntary ventilation,MVV)和第1 s用力呼气的容积(forced expiratory volume in one second,FEV1)等呼吸参数以及最大流速-容量环。5.运动方案实施:(1)测功计:根据试验室具备的条件、受试者的具体情况及医生的个人习惯选择平板或踏车作为测功计。一般认为平板试验测得的peakVO2比踏车试验高出约11%[30]。但对于老年受试者及有关节损伤的受试者踏车更为安全。无论选择何种测功计,均应小心防护,避免受伤。(2)运动方案:平板运动试验一般选用Bruce或Bruce改良方案;踏车运动试验一般选用Ramp方案,目前临床最常使用的方案是用踏车进行症状限制性递增运动试验,本共识将详细介绍踏车运动试验。通常情况下,踏车运动试验时Ramp方案的功率递增幅度按照如下公式计算[17]:预计无负荷VO2(ml·min-1)=150+[6×体重(kg)];预计peakVO2(ml·min-1)=[身高(cm)-年龄(岁)]×20(男性)或×14(女性)。一般建议在6~10 min内完成递增运动试验,如按10 min完成,则每分钟递增功率(W)=[peakVO2(ml·min-1)-无负荷VO2(ml/min)]/100。功率递增幅度的选择应在综合考虑受试者的病史、日常活动能力、心肺功能等状况后决定。对于年老、日常活动量较低、存在严重心血管或呼吸系统疾病的患者,应酌情减少功率递增幅度;对于运动员或有长期运动习惯者,则可适当提高功率递增幅度。(3)运动实施过程:静息期(3 min):获得静息心率、血压、心电图、静态气体代谢等指标。无负荷热身运动期(3 min):踏车速度保持在55~65 r/min,接近结束时记录心率、血压、心电图、血氧饱和度等指标。功率负荷期(6~10 min):踏车速度保持在55~65 r/min,测试者密切观察受试者症状、心率、血压、气体代谢指标、血氧饱和度及心电图改变。注意试验过程中可能出现的不良反应,如心绞痛、呼吸困难、头晕、面色苍白、出冷汗等症状,以及显著的快速或缓慢性心律失常、心电图缺血性改变、血压下降、休克等。运动中如果出现上述症状或指征,需立即终止试验并给予相应的观察和处理。恢复期(6~8 min):保持无负荷缓慢踏车2~3 min,踏车速度可维持在30~40 r/min,观察受试者的心率、血压、心电图以及症状。停止无负荷踏车,继续观察受试者心率、血压等生命指征是否恢复至测试前水平。如终止运动后症状和/或异常迹象持续超过15 min,建议进一步观察或治疗。6.运动后提问和再评估:运动后,通常需对受试者进行与诊断有关的非诱导式提问,如什么症状迫使其终止运动,自我感觉劳累程度如何,以进一步分析受试者运动受限的原因。7.CPET终止指标:多数情况下临床进行的是症状限制性的CPET,其终止指标如下:(1)出现中度至重度心绞痛;(2)出现眩晕、共济失调、发绀或面色苍白、严重疲乏、呼吸困难等;(3)心电图示相邻导联ST段水平型或下斜型压低≥0.2 mV,持续2 min及以上;ST段弓背向上型抬高≥0.1 mV;(4)出现严重心律失常,如二~三度房室传导阻滞、室性心动过速、频发室性早搏、新发快速心室率的心房颤动等;(5)随着功率递增,收缩压下降≥10 mmHg(1 mmHg=0.133 kPa)或持续低于基线血压;或收缩压≥220 mmHg和/或舒张压≥110 mmHg;(6)因下肢无力或肌肉疼痛、痉挛,导致踏车转速明显下降;(7)受试者要求终止运动。一、CPET主要参数
根据临床实践、文献证据支持及CPET各参数的含义和特点,本共识将CPET主要参数归纳为以下3类。
1.反映运动耐量以及心血管功能的指标:如peakVO2、AT、MET、最大氧脉搏(peakVO2/HR)、HRR、呼吸商(respiratory quotient,RQ)或呼吸交换比(respiratory exchange ratio,RER)、氧作功效率(ΔVO2/ΔW)、测试期的心电图、心率及血压变化等。
2.反映通气功能的指标:如呼吸储备(breathing reserve,BR)、MVV、潮气量(tidal volume,VT)、呼吸频率(breath frequency,Bf)、分钟通气量(minute ventilation,VE)、FEV1、VT/深吸气量(inspiratory capacity,IC)、运动振荡通气(exercise oscillatory ventilation,EOV)等。
3.反映气体交换的指标:如氧通气当量(VE/VO2)、二氧化碳通气当量(VE/VCO2)、生理无效腔/潮气量比值(VD/VT)、动脉氧分压(PaO2)、肺泡与动脉氧分压差[P(A-a)O2]、动脉二氧化碳分压(PaCO2)、潮气末氧分压(partial pressure of oxygen in end-tidal gas,PETO2)、潮气末二氧化碳分压(partial pressure of end-tidal carbon dioxide,PETCO2)、外周血氧饱和度(SaO2)等。
二、CPET报告解读
1.CPET报告主要内容:一般包括以下4部分内容:(1)受试者基本信息及静态肺功能:包括受试者的一般信息、临床资料及用药情况,与运动相关的症状和病史,以及静态肺功能测试结果;(2)运动测试方案:包括所用测功计(踏车或平板)、递增或恒定功率、功率递增幅度等;(3)运动期间和运动后指标:包括运动期间受试者的各项指标、运动用力情况,终止运动的原因等;(4)结果解释和建议:包括最大运动耐量、有氧运动能力,基于运动试验测试结果评价心血管功能、通气-血流失调和呼吸模式或储备,并提出可能的鉴别诊断或诊断建议。
2.CPET结果分析与报告解读:CPET结果的分析可遵循以下步骤[31]。
第一步:运动试验结束后,首先检查所获得的数据是否可靠,评估数据质量,判断运动试验所获得的信息是否与患者临床表现相符。如不符合,则要仔细分析原因,必要时需考虑是否重新进行CPET。
第二步:明确试验目的,进行数据分析。CPET主要目的包括:鉴别运动不耐受原因、评价疾病严重程度及评估预后、评估外科手术风险、评价医疗干预效果及指导运动处方制订。当CPET应用于鉴别运动不耐受的原因时,可根据终止运动试验的症状与测试过程中异常的参数指标,并结合受试者临床资料进行综合分析[17]。在数据分析时,可以根据peakVO2、AT、BR及VE/VCO2斜率4个主要指标,进行关联递进层次分析,具体流程参见图1, 2, 3。CPET应用于其他目的的具体情况可见后文详述。
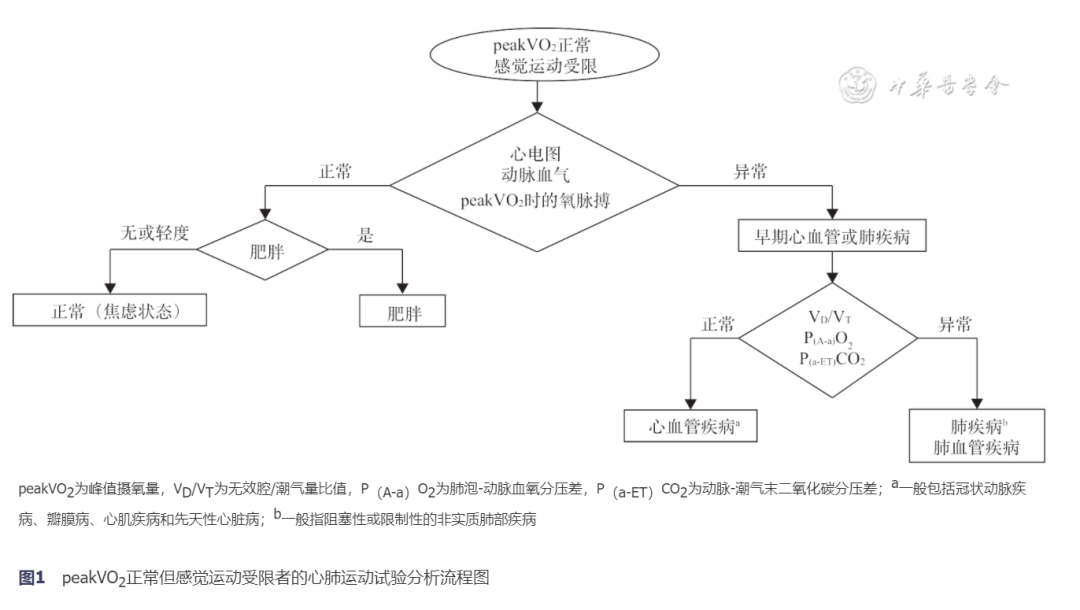
第三步:结合试验目的得出本次试验结论,回应申请单上临床医生提出的目的和要求。一、CPET用于相关疾病的诊断及风险评估
1.冠心病:对于有冠心病高危因素的患者,CPET是临床评估的重要方法[32, 33]。近年来的一些研究已证明其在冠心病诊断方面的潜在价值[34-36]。
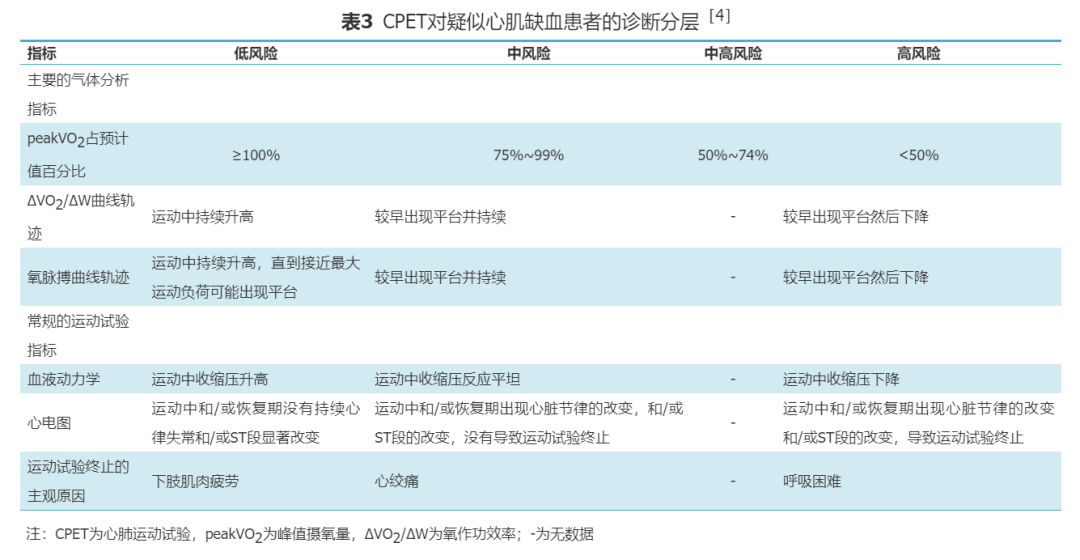
CPET在评估运动性心肌缺血时,氧脉搏及ΔVO2/ΔW轨迹的实时变化是最有价值的指标。在正常生理条件下,氧脉搏与VO2随着负荷量递增,呈现出持续而稳定的线性递增;当由于心肌缺血引起左心室功能障碍时,会导致氧脉搏与VO2曲线随着负荷功率的递增,出现递增减少、不变或下降的非线性变化。将氧脉搏及ΔVO2/ΔW轨迹随功率增加出现非线性递增作为运动诱发心肌缺血的诊断标准,其灵敏度和特异度分别为87%和74%,均高于单独通过运动负荷心电图异常诊断运动诱发的心肌缺血[37]。增加氧脉搏及ΔVO2/ΔW轨迹的分析可协助排除心电图诊断的假阳性患者[38]。本共识根据2012年EACPR与AHA的科学声明推荐对疑似心肌缺血患者进行诊断分层(表3)[4]。peakVO2占预计值百分比从低风险到高风险逐渐下降提示心肌缺血进展和心肺功能水平的下降;氧脉搏和ΔVO2/ΔW的曲线轨迹进展到高风险程度提示心肌缺血;血液动力学和心电图反应进展到中风险及中高风险提示心肌缺血,如果进展到高风险则提示运动性心肌缺血,结合患者基线的体征、症状和危险因素均可提示罹患冠心病的可能性增加,同时也提示预后不佳。
2.慢性心力衰竭(chronic heart failure,CHF):CHF是一种全身性综合征,功能减退是其主要特征之一。CPET被认为是评估CHF患者运动耐量的“金标准”,对CHF患者的预后评估有重要意义[2]。既往文献已表明CPET中的主要变量,如peakVO2和VE/VCO2斜率可用于预测射血分数减低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)患者的不良事件及疾病严重程度[39, 40]。研究发现,peakVO2<14 ml·min-1·kg-1或<预测值的50%提示CHF患者预后不良[23,41]。Ferreira等[42]发现VE/VCO2斜率≥43是判断存在心力衰竭的理想切点值,相比经典的基于peakVO2的标准,可准确重新分类18.3%的CHF患者。VE/VCO2斜率≥45且peakVO2<10.0 ml·min-1·kg-1的CHF患者,未来4年内预后极差[43]。此外,摄氧量效率斜率(oxygen uptake efficiency slope,OUES)、EOV、静息和运动时的PETCO2等指标对HFrEF患者预后均有较强的预测价值[44, 45, 46, 47]。本共识根据2012年EACPR与AHA的科学声明给出CHF患者预后和诊断分层的标准(表4)[4]。随着相关指标逐渐进展到高风险区域,提示CHF程度更加严重和主要不良事件(死亡、心力衰竭失代偿和难治性心力衰竭)发生的可能性增加。而软终点发生的可能性,如心力衰竭再住院,也随着相关指标进展到高风险区域而增加。其中peakVO2和VE/VCO2斜率位于高风险区域被视为心脏移植的主要指标。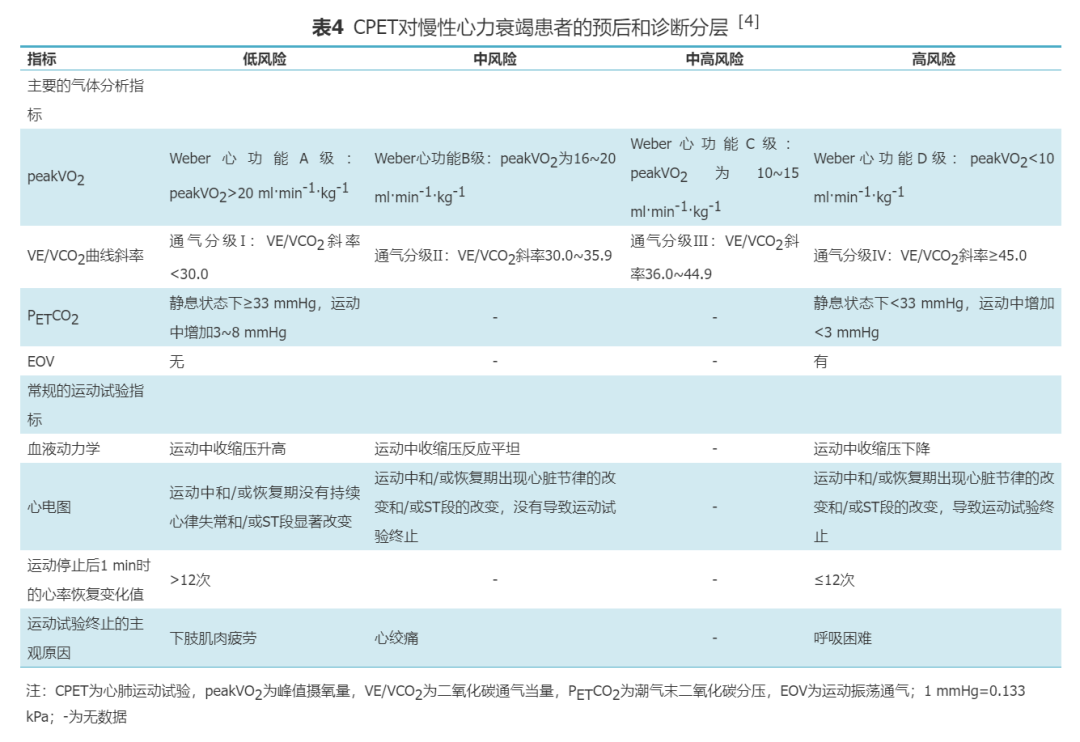
目前已有多项研究支持CPET可用于测定射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)患者的舒张功能障碍水平和预后评估[37,48, 49, 50]。此外,一些研究也支持CPET对先天性心脏病患者预后的评估有重要意义[51, 52]。表4同样适用于HFpEF患者和先天性心脏病患者。3.肺动脉高压(pulmonary arterial hypertension,PAH):肺血管疾病的早期,平均肺动脉压(mean pulmonary arterial pressure,mPAP)水平可正常。当静息状态下的mPAP水平升高超过50%时,才会引起症状,这导致肺血管疾病检出相对滞后[53, 54]。CPET可在无创情况下,通过记录和分析运动过程中气体代谢变化发现通气与灌注异常情况,协助可疑PAH患者的早期诊断及已确诊PAH患者的预后判断。尽管目前此类疾病并非CPET的标准临床适应证,但支持在疑诊或确诊PAH患者中应用CPET的证据在迅速增多。CPET可用于评估PAH患者运动耐量、治疗效果和预后判断。PAH患者的CPET主要表现为VE/VCO2斜率升高、peakVO2降低、PETCO2降低[55]。在没有急性过度通气时,AT时的VE/VCO2斜率>37且PETCO2<30 mmHg,提示可能存在肺血管疾病[56]。运动中的PETCO2峰值过低(<20 mmHg)在其他疾病中并不常见,在评价运动相关性呼吸困难的患者时,该指标过低高度提示可能存在PAH[57]。Wensel等[58]关于特发性PAH的研究结果表明,peakVO2<10.4 ml·min-1·kg-1,峰值收缩压<120 mmHg,预示患者死亡率明显升高。本共识根据2012年EACPR与AHA的科学声明给出PAH患者预后和危险分层的标准(表5)[4]。所有指标均在低风险区域提示预后良好,可维持目前治疗并定期复查评估。越多指标处于中风险、中高风险及高风险区域提示预后进行性恶化,肺血管病严重程度进一步增加,患者需更优化的医学干预。所有指标均在高风险区域提示未来1~4年发生恶性心血管事件的风险显著增加。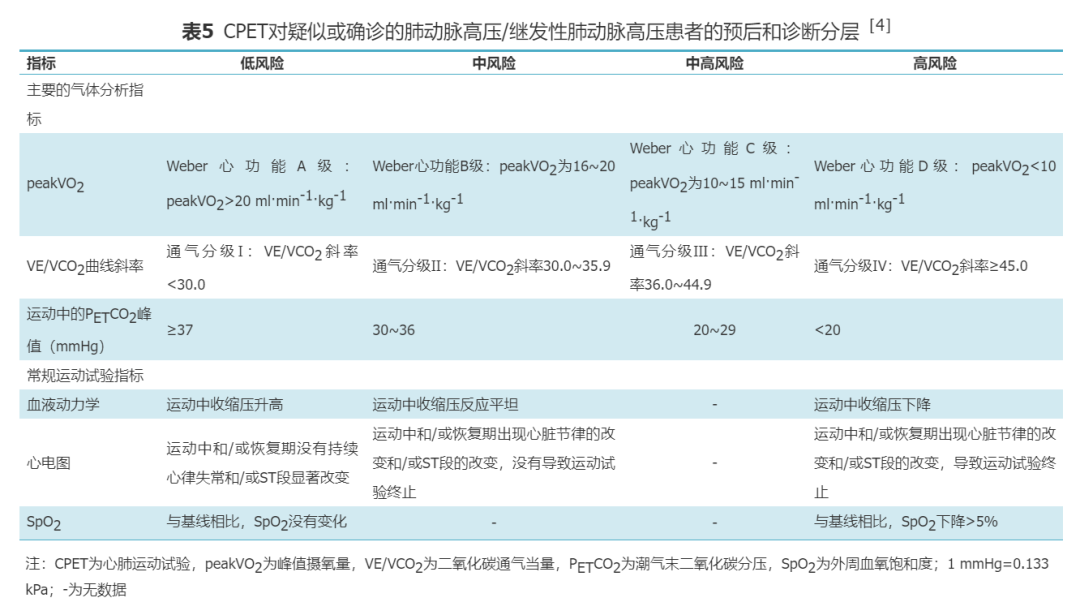
4.肥厚型心肌病(hypertrophic cardiomyopathy,HCM):CPET对疑似或确诊HCM患者的危险分层和预后评估有良好实用性。尽管2002年美国心脏病学会(American College of Cardiology,ACC)/AHA运动试验指南指出HCM为运动试验的相对禁忌证[28],但随后多个研究证明了此项操作的安全性[59-61]。peakVO2有助于区分与HCM相关的左心室肥厚(left ventricle hypertrophy,LVH)和生理性LVH。如运动员可能因长期从事体育活动而产生生理性的LVH。运动员的peakVO2通常超过预计值,但在HCM患者中,只有1.5%的患者peak VO2超过预计值。因此CPET在临床上可帮助鉴别无症状的年轻HCM患者[62]。通气效率(特别是VE/VCO2斜率)和运动过程中的PETCO2峰值与LVH晚期舒张功能障碍所导致的PAH相关[63]。此外,有证据表明,有氧运动能力和通气效率是症状程度较轻的梗阻型HCM患者预后评估的重要参考指标[64]。本共识根据2012年EACPR与AHA的科学声明提供了疑似或确诊的HCM患者的危险分层和预后评估的标准[4],CPET相关指标逐步进展到中风险、中高风险及高风险区域是疾病恶化和猝死等不良事件风险增加的迹象(表6)。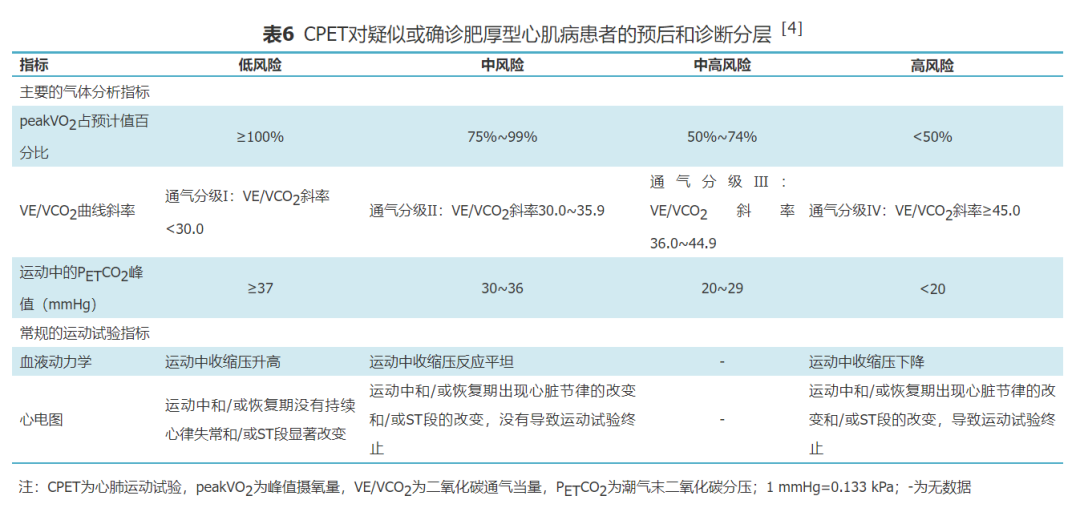
5.外科手术:CPET在外科手术风险和预后评估中有显著的临床价值。术前CPET检查可准确评估围手术期不良事件的风险,同时还能评估患者术后长期预后[65-68],为手术的安全性提供重要参考。腹部手术中,AT值及peakVO2与术后并发症发生风险相关性较强,且AT值的灵敏度优于peakVO2[67]。对于胸外科手术患者,peakVO2<15 ml·min-1·kg-1发生手术并发症的风险增加[69],peakVO2<10 ml·min-1·kg-1为高风险,围手术期病死率明显增加[68]。目前的文献支持将peakVO2、AT值以及VE/VCO2斜率作为术前风险评估的最重要的参考指标[67,70]。本共识根据2016年EACPR与AHA的科学声明提供了危险分层标准,用以量化评估手术风险和预后风险[5]。所有指标均在低风险区域提示预后良好,围手术期发生并发症的风险低;越多指标位于中风险、中高风险及高风险区域,提示预后进行性恶化,围手术期并发症风险越高;所有指标均位于高风险区域时,提示围手术期发生重大不良事件或并发症的风险极高,且长期预后差(表7)。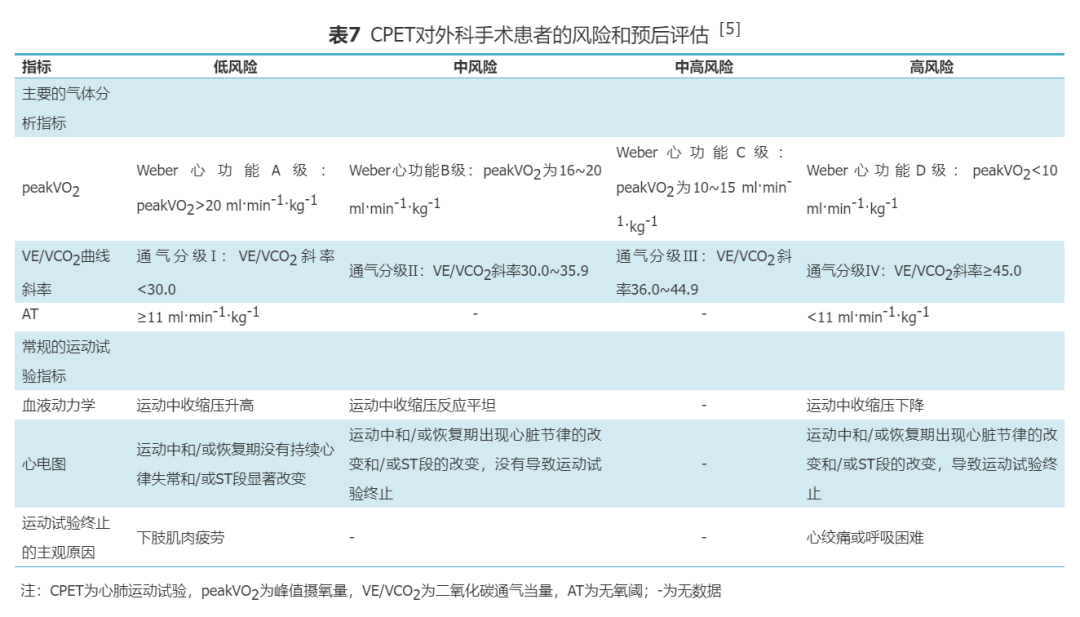
CPET通过测定患者的peakVO2、AT、峰值心率、峰值负荷等指标,评估有氧运动能力和心肺储备能力,制定运动处方的目标运动量、目标靶心率等;同时CPET还可检测出运动相关不良反应,如缺血、缺氧、心律失常、血压改变等,评估患者的疾病危险分层,是准确、安全制订心脏康复运动处方的重要依据。个体化的适宜的运动强度是确保运动治疗安全性和有效性的关键。运动强度可设置为最大运动能力的40%~80%。危险分层为中至高风险的患者初始运动强度为最大运动能力的40%~50%,危险分层为低风险的患者初始运动强度为最大运动能力的60%~70%,随着体能、病情变化随时调整。绝对运动强度是指运动期间的物理负荷强度,通常以km/h或MET表示[71]。相对运动强度是指在运动期间与个体能力相适应的负荷强度,通常以peakVO2百分比表示[72];也可表示为运动试验期间记录的HRmax的百分比[73]。此外,运动强度还可采用个体的HRR的百分比来表示[74](表8)。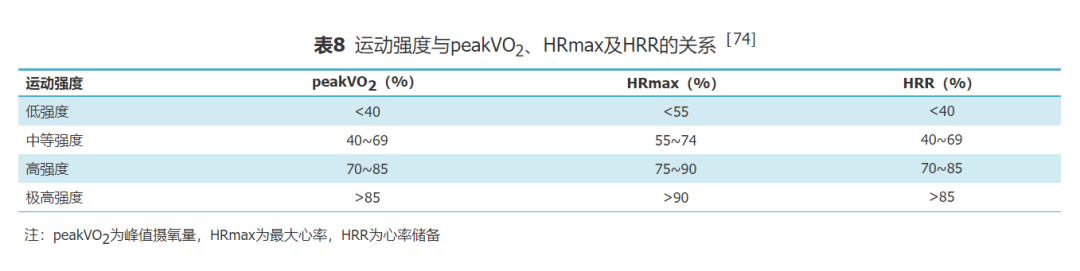
对于正在使用β受体阻滞剂的患者,如果以心率相关指标制订运动处方,要确保接受CPET时患者已规律用药。对于疑似或确诊的冠心病患者,在制定运动处方时需要考虑患者是否存在运动诱发的心肌缺血表现。如在运动过程中出现心绞痛、心电图显著的ST-T改变伴或不伴有氧脉搏曲线下降、血压下降,可能提示左主干或对等病变,必要时行进一步评价和干预[75]。出于安全考虑,建议选择运动试验中稍低于诱发心肌缺血的强度作为运动强度,运动训练时建议心率、血压以此为上限[27]。CPET有助于发现运动诱发的心肌缺血、心律失常、血液动力学异常等不良反应,还可评估症状或体征与运动训练的相关性[76]。对于冠心病、心力衰竭、心肌病患者和老年人,CPET是评估整体心血管功能和运动能力的有效方法。推荐上述人群在运动康复前,排除禁忌证后进行CPET检测,以便就运动类型和强度提出个性化建议,保证运动安全和运动效果[77]。如果在CPET测试过程中出现胸痛、气促、头晕等明显不适,或心电图出现显著的ST-T改变,或复杂性室性心律失常,或异常的血液动力学反应,尤其是血压下降,均应视为运动高危人群,建议在医生指导和医学监测下或在必要干预治疗后进行运动康复[78]。对于病情相对稳定的患者,其运动生理反应是可重复的。CPET可提供用于评价患者治疗干预效果所需要的可重复的客观信息。将CPET用于评价疗效时,实验室定标的准确性、使用敏感的终点指标及保持方法学一致是非常必要的。CPET可用于冠心病、CHF等心血管疾病患者运动康复疗效评价。如HF-ACTION研究以peakVO2作为评估患者运动耐量的指标。该研究表明,运动康复可降低HFrEF患者全因死亡和住院联合终点7%的发生风险,提高0.5 ml·min-1·kg-1 的peakVO2[79]。此外,CPET亦可用于各种药物的疗效评价。如缺血性心肌病患者经曲美他嗪联合运动训练干预8周后,运动耐量及LVEF改善,peakVO2提高25%,AT、VE、峰值氧脉搏等指标均明显提高[80]。新型治疗心力衰竭的药物沙库巴曲缬沙坦能提高心力衰竭患者的生存率和生活质量,提高HFrEF患者的peakVO2及氧脉搏、降低VE/VCO2曲线斜率[81]。CPET多项主要测定指标对外科干预效果有良好反应,可用于治疗效果的精确和客观定量评价。近来的研究表明,心肌梗死患者经皮冠状动脉介入治疗术后急性期内达到AT时的VO2≥10.5 ml·min-1·kg-1,在未来2年有更好预后[82]。孙兴国等[83]报道了心脏瓣膜置换术后患者CPET测定的主要指标,发现peakVO2、峰值氧脉搏、VE/VCO2曲线斜率等指标均有明显改善。一、试验室仪器设备的维护
测试人员必须对气体交换分析设备、心电监测设备、除颤仪等抢救设备进行定期维护和校准,确保仪器处于良好功能状态。同时,还需定期对抢救药品进行清点、核对,做好登记工作,及时更换,避免药物过期。
二、测试人员的教育和培训
测试人员需接受CPET相关培训,如运动生理学知识或肺功能测试技能,需掌握受试者正常或异常运动反应的基本知识,能够识别心电图上的心律失常和缺血性改变。测试人员必须有3个月以上的CPET测试经验,以保证紧急情况下能立即作出反应。
三、建立并实施质量保证计划
建议每6个月进行一次质量控制。质量控制应主要针对测试者对流程是否熟悉、操作过程是否规范、不良反应识别是否准确、抢救措施是否准备充分等方面进行。质量控制也可保证检查执行的一致性。
无论是运动不耐受的诊断和鉴别诊断、心血管相关疾病的预后风险评估,还是医疗干预效果评价或运动处方制订指导,CPET均具有重要的临床价值。为保证CPET的安全性和准确性,正确指导临床实践,各级别的医疗单位均可以本共识为参照,开展规范化标准化的高质量CEPT。因篇幅所限,本共识未能详述CPET在肺部疾病等的临床应用。
执笔专家:范志清(大庆油田总医院),曹鹏宇(吉林大学附属第一医院),江巍(广东省中医院),王磊(南京中医药大学鼓楼医院),张剑(北部战区总医院)
核心专家组成员:胡大一(北京大学人民医院),韩雅玲(北部战区总医院),杨新春(首都医科大学附属北京朝阳医院),王乐民(上海同济大学附属同济医院),孟晓萍(长春中医药大学附属医院),范志清(大庆油田总医院),张剑(北部战区总医院),曹鹏宇(吉林大学附属第一医院),王磊(南京中医药大学鼓楼医院),江巍(广东省中医院),郭兰(广东省人民医院),孙兴国(中国医学科学院阜外心血管病医院)
共识专家组成员(按姓氏汉语拼音排序):边惠萍(青海省心脑血管病医院),布艾加尔(南京明基医院),曹鹏宇(吉林大学附属第一医院),才晓君(济南市中心医院),陈桂英(哈尔滨医科大学附属第一医院),戴翠莲(厦门市心血管病医院),丁荣晶(北京大学人民医院),董少红(深圳市人民医院),戴若竹(泉州市第一医院),董吁钢(中山大学附属第一医院),范志清(大庆油田总医院),高海青(山东大学齐鲁医院),郭建军(首都体育学院),耿庆山(广东省人民医院),郭兰(广东省人民医院),郭琪(上海健康医学院),韩雅玲(北部战区总医院),姜冬梅(浙江大学邵逸夫医院),江巍(广东省中医院),姜翠玲(淄博矿业中心医院),孔永梅(山西省心血管病医院),李凌(郑州大学附属第一医院),李真(大连医科大学附属第一医院),李景君(南方医科大学南方医院),李秀丽(南昌医科大学附属第二医院),梁崎(中山大学附属第一医院),梁延春(北部战区总医院),刘静(首都医科大学附属北京安贞医院),刘慧(安阳地区人民医院),刘美霞(河北省人民医院),刘培良(辽宁省金秋医院),刘遂心(中南大学湘雅医院),陆晓(江苏省人民医院),孟晓萍(长春中医药大学附属医院),任爱华(浙江医院),潘燕霞(福建医科大学健康学院),曲鹏(大连医科大学附属第二医院),沈琳(山东大学齐鲁医院),沈玉芹(上海同济大学附属同济医院),申晓彧(山西医科大学附属第二医院),斯琴高娃(内蒙古自治区人民医院),陶蓉(上海瑞金医院),王东伟(郑州市中心医院),王珺楠(吉林大学附属第二医院),王乐民(上海同济大学附属同济医院),王磊(南京中医药大学鼓楼临床医学院),魏瑾(西安交通大学附属第二医院),谢萍(甘肃省人民医院),徐俊波(成都市第三人民医院),许海燕(中国医学科学院阜外心血管病医院),许丹焰(湘雅医学院附属第二医院),许滔(贵州省中医院),杨莉(昆明市延安医院),杨新春(首都医科大学附属北京朝阳医院),于海初(青岛大学附属医院),岳瑞华(重庆市第四医院),张存泰(华中科技大学附属同济医院),张剑(北部战区总医院),张啸飞(北京清华长庚医院),张子新(中国医科大学附属第一医院),赵冬(首都医科大学附属北京安贞医院),赵文华(中国疾病预防控制中心),赵玉兰(郑州大学附属第二医院),赵明明(广西壮族自治区江滨医院)
利益冲突 所有作者均声明不存在利益冲突