慢性心力衰竭(chronic heart failure,CHF)是全球死亡的主要原因之一,其是各种心血管疾病的严重表现或终末阶段,由心脏结构和(或)功能异常改变引起心室收缩功能和(或)舒张功能障碍导致,以液体潴留(外周水肿、体循环淤血、肺淤血)、疲乏、和呼吸困难等为主要临床表现,具有高发病率、住院率、病死率、医疗费用等特点。近年来随着人口老龄化的加剧及各种心血管疾病患者生存期的延长,我国慢性心力衰竭负担持续加重,截止2020年我国现患心力衰竭人数高达890万,住院病死率为2.8%,疾病负担严峻。衰弱是个体多系统生理功能储备降低,抗应激能力和自身稳态维持能力下降,而对应激事件易感性增加的危险状态。慢性心力衰竭与衰弱常共存,衰弱能加速降低患者个体功能,延长患者住院时间和增加病死率。鉴于衰弱对慢性心力衰竭患者预后的重要影响,早期准确地识别危险患者很有必要。本研究旨在分析慢性心力衰竭患者发生衰弱的影响因素及其对住院期间不良事件的影响,以期为降低慢性心力衰竭患者衰弱发生和促进预后改善提供参考。
1. 资料与方法
1.1 研究对象
选取2019年1月~2023年1月于四川省西昌市人民医院心内科收治的857例慢性心力衰竭患者,男性558例,女性299例;年龄38~82岁,平均年龄(65.07±5.52)岁;体质指数(BMI)17.22~31.20kg/m2,平均BMI(24.32±2.21)kg/m2;病程2~14年,中位6.00(3.00,9.00)年;纽约心脏协会(New York Heart Association,NYHA)心功能分级:Ⅰ~Ⅱ级340例、Ⅲ~Ⅳ级517例。纳入标准:年龄≥18岁;符合《中国心力衰竭诊断和治疗指南2018》CHF诊断标准。排除标准:①其他类型心力衰竭(如急性心力衰竭、急性失代偿性心力衰竭);②妊娠及哺乳期妇女;③恶性肿瘤、自身免疫性疾病、血液系统疾病、精神疾病患者;④资料不完整;⑤生命体征不稳定、配合度差等原因不能进行衰弱评估;⑥严重肝肾功能不全。本研究经四川省西昌市人民医院伦理委员会批准(批号[2023伦审041号]),患者及/或家属均知情并自愿签署知情同意书。
1.2 衰弱评价
CHF患者入院后立即使用中文版蒂尔堡衰弱指数评价衰弱,包括社会、精神、体能3个维度共15个项目,≥5项表示衰弱,该量表Cronbach'sα系数为0.686。根据是否发生衰弱将CHF患者分为衰弱组和非衰弱组。
1.3 资料收集
收集慢性心力衰竭患者性别、年龄、体质指数、病程、吸烟史、NYHA心功能分级、心血管疾病史[高血压、糖尿病、冠心病、脑卒中史、高脂血症、心房颤动/心房扑动]、居住地、婚姻状况、文化程度、职业、超声心动图指标[左心室舒张末期内径(left ventricular enddiastolic diameter,LVEDD)、左室射血分数(left ventricular ejection fraction,LVEF)]和实验室指标[白细胞计数、淋巴细胞计数、中性粒细胞计数、血红蛋白、血小板计数、N末端脑钠肽前体(N-terminal pro-B-type natriuretic peptide,NTproBNP)、血肌酐、血尿酸、血尿素氮]等资料。
1.4 不良事件定义
统计慢性心力衰竭患者住院期间不良事件发生情况,主要终点事件为院内死亡,次要终点事件包括恶性心律失常(室性心动过速/心室扑动、窦性停搏、高度或Ⅲ°房室传导阻滞等)、器官衰竭、心源性休克等。
1.5 统计学分析
本研究数据使用统计学软件SPSS28.0版本处理。计数资料以频数(百分比)表示,组间比较采用x²检验;正态分布计量资料以均数±标准差(x̄±s)表示,两组间比较采用t检验;非正态分布计量资料以中位数(四分位数)[M(P25,P75)]表示,两组间比较采用U检验;将单因素分析有差异项目纳入多因素Logistic回归模型分析影响患者衰弱的因素;P<0.05为差异有统计学意义。
2 结果
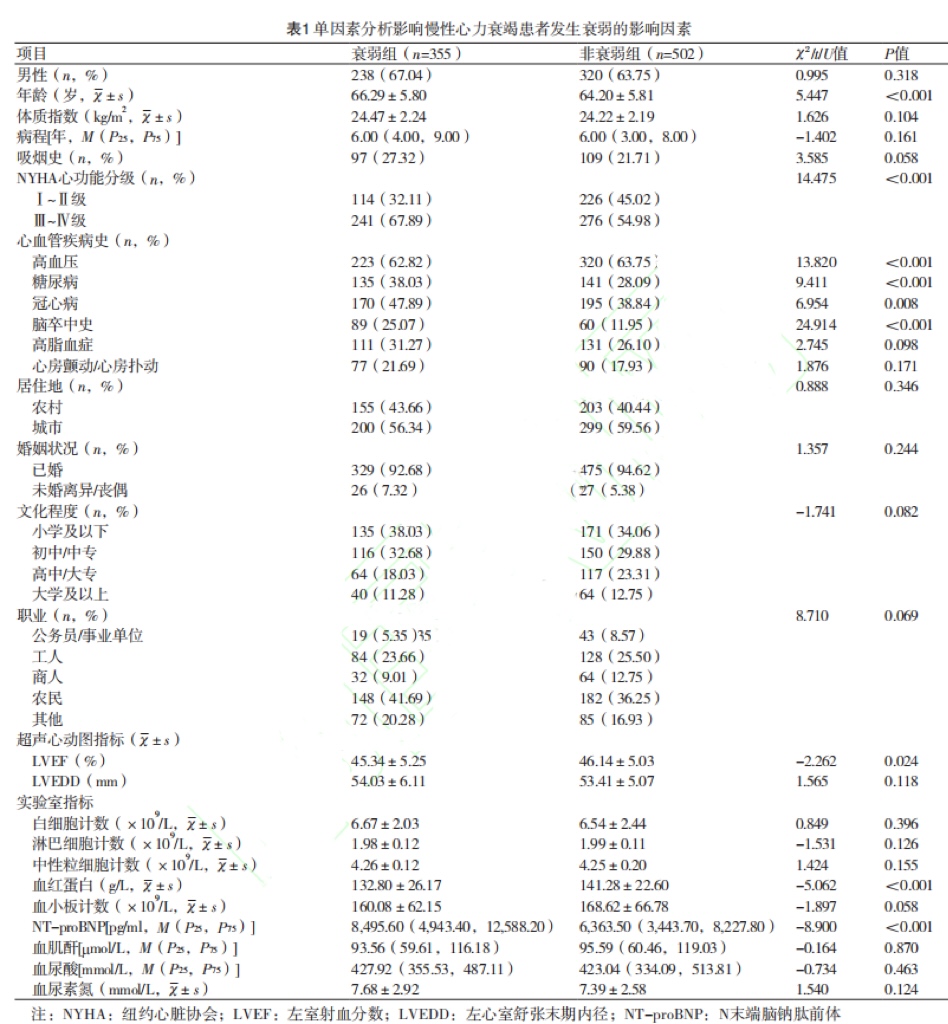
2.1 单因素分析影响慢性心力衰竭患者发生衰弱的影响因素
857例慢性心力衰竭患者有355例发生衰弱,衰弱发生率为41.42%(355/857)。单因素分析显示,衰弱组年龄大于非衰弱组,NYHA心功能分级Ⅲ~Ⅳ级、高血压、糖尿病、冠心病、脑卒中史比例和NT-proBNP高于非衰弱组,LVEF和血红蛋白低于非衰弱组(P<0.05),(表1)。
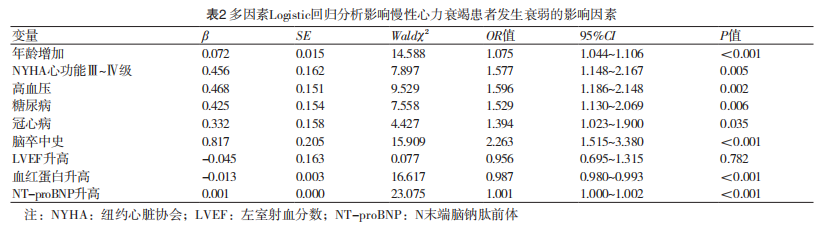
2.2 多因素Logistic回归分析影响慢性心力衰竭患者发生衰弱的影响因素
以发生衰弱(是/否=1/0)为因变量,表1单因素分析有差异P<0.05项目包括年龄(原值录入)、NYHA心功能分级(Ⅲ~Ⅳ级/Ⅰ~Ⅱ级=1/0)、高血压(是/否=1/0)、糖尿病(是/否=1/0)、冠心病(是/否=1/0)、脑卒中史(是/否=1/0)、LVEF(原值录入)、血红蛋白(原值录入)、NT-proBNP(原值录入)为自变量,建立影响CHF患者发生衰弱的多因素Logistic回归模型。结果显示,年龄增加、NYHA心功能分级Ⅲ~Ⅳ级、高血压、糖尿病、冠心病、脑卒中史和NT-proBNP升高为影响慢性心力衰竭患者发生衰弱的独立危险因素,血红蛋白升高为独立保护因素(P<0.05),(表2)。
2.3 住院期间不良事件发生率比较
857例慢性心力衰竭患者住院期间共发生201例不良事件,不良事件发生率为23.45%(201/857)。衰弱组发生恶性心律失常53例、器官衰竭31例、心源性休克18例、院内死亡14例,住院期间不良事件发生率为32.68%(116/355);非衰弱组发生恶性心律失常50例、器官衰竭20例、心源性休克10例、院内死亡5例,住院期间不良事件发生率为16.93%(85/502);衰弱组住院期间不良事件发生率高于非衰弱组(x²=28.710,P<0.001)。
3 讨论
慢性心力衰竭给全球造成了巨大的经济和社会负担,以老年人群居多,是老年人群失能、死亡、住院、医疗费用增加等重要原因,尽管近年来其治疗领域取得一定进展,开发了新的药物和治疗方法,但其病死率和再住院率仍然较高,已成为全球公共卫生问题。衰弱被定义为是老年人由于生理储备下降而引起的抗应激能力的非特异性状态,这一状态会增加个体依赖性、脆弱性、死亡易感性。但最近欧洲心脏病学会心力衰竭协会指出,心力衰竭中的衰弱是一种可逆/动态的多维状态,各年龄段均可发生,在一个或多个临床和非临床领域对应激源的易感性增加,从而导致负面结果和不良预后。目前尚无针对心力衰竭患者衰弱的评价方法,研究衰弱的影响因素对χ改善患者预后至关重要。但目前相关研究均以老年慢性心力衰竭为研究对象,忽略了衰弱与慢性心力衰竭患者整体的关系。
本研究通过多因素Logistic回归分析发现,年龄、NYHA心功能分级、高血压、糖尿病、冠心病、脑卒中史、NT-proBNP和血红蛋白为CHF患者发生衰弱的独立影响因素,具体原因分析如下:①年龄:本研究结果显示,慢性心力衰竭患者年龄每增加1岁,发生衰弱的风险增加1.075倍,这与既往研究报道相符。衰弱虽然不被欧洲心脏病学会心力衰竭协会视为“与年龄相关的生理储备和功能的进行性下降”和“老年综合征”。但衰弱本身是一种复杂的多因素综合征,随着年龄的增加,个体器官逐渐退化和身体储备能力下降会导致衰弱风险增加。同时老年慢性心力衰竭患者通常合并多种基础疾病、营养不良、不合理用药、睡眠障碍、焦虑/抑郁、缺乏运动等,这些可控或不可控因素也会导致衰弱风险增加。②NYHA心功能分级:本研究结果显示,NYHA心功能分级Ⅲ~Ⅳ级相比较Ⅰ~Ⅱ级的CHF患者,发生衰弱的风险增加1.577倍,分析与心功能降低影响衰弱发生有关。NYHA心功能分级越高反映慢性心力衰竭患者心功能越差,心功能降低会进一步降低机体运动能力,且危重症状态分解代谢状态信号增强,加速器官功能减退和身体储备下降,导致发生衰弱的风险增加。罗瑶等研究也报道,住院患者心脏结构和功能越差,发生衰弱的风险越高。③高血压:本研究结果显示,患有高血压的慢性心力衰竭患者发生衰弱风险增加1.596倍,考虑与高血压与衰弱具有共同作用机制有关。目前研究认为,衰弱的病理生理学机制与炎症反应、氧化应激、能量代谢不足、神经内分泌异常等多系统级联效应相关,这些病理生理学机制会引起全身多系统(包括免疫系统、代谢内分泌系统、神经系统等)构成的稳态网体系受损,降低抗打击能力和生理储备,最终引起衰弱。高血压是一个涉及炎症、氧化应激和神经内分泌异常的疾病,高血压过程中炎症反应、氧化应激增强和神经系统异常会增加衰弱风险。陈雨萍等通过衰弱量表分析社区老年高血压患者发现,衰弱在老年高血压患者中发生率为38.2%。④糖尿病:本研究结果显示,患有糖尿病的慢性心力衰竭患者发生衰弱风险增加1.529倍,考虑与糖尿病与衰弱具有共同作用机制有关。因为胰岛素抵抗是炎症反应、氧化应激等机制参与的复杂过程,因此可能影响衰弱发生。此外,糖尿病患者低血糖(意识模糊)/高血糖(炎症反应、氧化应激增强)、内分泌代谢紊乱、多重用药等情况也会增加衰弱发生风险。戈倩等研究也指出,糖尿病患者血糖水平控制情况与衰弱发生密切相关,过高或过低的血糖水平均会引起衰弱。⑤冠心病:本研究结果显示,患有冠心病的慢性心力衰竭患者发生衰弱风险增加1.394倍,分析也与二者具有共同的发病机制有关。冠心病患者多合并有内分泌代谢异常,如胰岛素抵抗、维生素D缺乏、雄激素水平下降、血脂紊乱等,会增加衰弱发生风险。同时冠心病由动脉粥样硬化狭窄或阻塞冠状动脉所致,该过程中炎症反应、氧化应激也会增加衰弱发生风险。⑥脑卒中史:本研究结果显示,有脑卒中史的慢性心力衰竭患者发生衰弱风险增加2.263倍,这与既往研究报道脑卒中患者衰弱发生风险增加的结果相符。脑卒中是局部脑组织缺血/出血引起的急性神经系统功能障碍,这种危重症状态势必会导致患者多种激素-代谢轴紊乱,增加衰弱发生风险。同时,有脑卒中病史的患者因脑组织损伤可能遗留不同程度的后遗症,脑血管损伤、活动范围缩小、运动能力降低、骨骼肌数量减少、肌力下降等原因也会增加衰弱发生风险。⑦血红蛋白:本研究结果显示,慢性心力衰竭患者血红蛋白每升高1.00g/L,发生衰弱的风险降低1.014倍,考虑与其反映营养状态有关。营养在衰弱过程中发挥核心作用,营养不良通过降低机体抵抗力、增强炎症、降低肌肉力量等机制引起衰弱。血红蛋白是营养重要的评价指标,机体缺乏蛋白质会导致血红蛋白生成减少,同时血红蛋白降低也会引起贫血,长期贫血损伤多器官功能,降低生理储备和功能而增加衰弱发生风险。⑧NTproBNP:本研究结果显示,慢性心力衰竭患者NT-proBNP每升高1.00pg/ml,发生衰弱的风险增加1.001倍,考虑与心功能降低有关。NT-proBNP是目前评价慢性心力衰竭病情和预后最重要的生物标记物之一,在心室受到压力负荷后大量分泌入血,是评价心脏功能的理想指标。慢性心力衰竭患者血清NT-proBNP水平越高则反映患者心功能越差,心功能降低通过影响运动能力、增强分解代谢等途径增加衰弱发生风险。
衰弱作为慢性心力衰竭常见的合并症,慢性心力衰竭合并衰弱后会进一步增加负面结果和不良预后,降低患者预后。本研究结果显示,衰弱患者住院期间不良事件发生率较非衰弱患者显著增加,符合既往报道衰弱会增加慢性心力衰竭患者预后不良风险的结果。分析其原因可能为:衰弱会增强患者分解代谢状态,加速机体能量消耗,引起全身肌量/肌强度下降和心功能持续进行性恶化,进展为心脏恶病质,导致不良事件发生率增加。本研究结果还需多中心、大样本研究验证;同时目前尚无针对心力衰竭患者衰弱的评价方法,还需进一步研究。
综上所述,慢性心力衰竭患者发生衰弱与年龄、NYHA心功能分级、高血压、糖尿病、冠心病、脑卒中、NT-proBNP和血红蛋白有关,且衰弱会导致慢性心力衰竭患者住院期间不良事件发生率增加。
声明:
1.本网站所有内容,凡是注明 “来源:心脏康复网”的文字、图片和音视频资料,授权转载时须请注明“来源:心脏康复网”。
2.本网所有转载文章系出于学术分享的目的,版权归原作者所有。如有侵权,请及时联系我们更改或删除。