多囊卵巢综合征(polycystic ovary syndrome, PCOS)是育龄期女性常见的内分泌及代谢性疾病,其临床症状主要表现为月经稀发、肥胖、血脂异常、雄激素过多等,常伴有胰岛素抵抗(insulin resistance, IR)和炎症反应。肥胖是PCOS的重要危险因素,约50%~80%的PCOS患者合并超重或肥胖。超重或肥胖PCOS患者更容易出现空腹胰岛素、空腹血糖(fasting plasma glucose, FPG)和血脂升高等代谢紊乱现象。体重指数(body mass index, BMI)越高,合并IR、高雄激素血症(hyperandrogenemia, HA)和代谢综合征的风险越高。作为一种复杂的异质性疾病,PCOS的发病机制至今仍未完全明确。研究发现,与非肥胖PCOS患者相比,肥胖PCOS患者(BMI≥24kg/m2)的肠道菌群Alpha多样性显著降低,且菌群结构显著不同,而前者的菌群结构与健康人群无显著差异,此外还发现Alpha多样性与BMI呈负相关。已有多项研究证实肠道菌群的变化与IR、HA、慢性炎症和代谢综合征有关,并可能通过短链脂肪酸(short chain fatty acids, SCFA)、脂多糖(lipopolysaccharide, LPS)等肠道代谢物影响PCOS的临床表现。
生活方式干预是目前公认的治疗超重或肥胖PCOS患者的一线方案。研究表明,减轻5%的体重可显著改善胰岛素敏感性,降低体内雄激素水平。然而国内对超重或肥胖PCOS患者进行生活方式干预的研究不多,且其潜在的分子机制目前尚未清楚。因此,本研究对超重或肥胖PCOS患者进行了为期6个月的生活方式综合管理,并通过宏基因测序技术分析干预前后肠道菌群的分布和组成差异,以期为该人群的治疗提供理论依据,现报道如下。
1 对象与方法
1.1 对象
采用自身前后对照的方法,选取2022年9月至2023年7月就诊于杭州市妇产科医院妇科内分泌科的超重或肥胖PCOS患者22例(入组25例,脱落3例)。纳入标准:(1)年龄18~40岁的女性。(2)符合PCOS诊断,诊断标准参照2003年欧洲人类生殖与胚胎学学会(European Society of Human Reproduction and Embryology, ESHRE)和美国生殖医学学会(American Society for Reproductive Medicine, AS-RM)于鹿特丹会议上制定的标准:①雄激素过多的临床和(或)生化表现,如多毛、痤疮、雄激素性脱发、血清总睾酮或游离睾酮升高;②稀发排卵或无排卵;③卵巢多囊性改变,即单侧或双侧卵巢体积增大单侧超过10cm或双侧卵巢内2~9mm的卵泡数>12个。上述3项中符合2项且排除甲状腺功能异常、先天性肾上腺皮质增生症、高泌乳素血症、分泌雄激素的肿瘤、库欣综合征等即可诊断为PCOS。(3)24kg/m2≤BMI<32kg/m2。本研究BMI上限参照《减重手术的营养与多学科管理专家共识》中的手术适应证:建议BMI≥32kg/m2,至少合并1个严重的肥胖相关疾病(如高脂血症),可考虑行减重手术治疗。(4)自愿接受PCOS的生活方式综合管理。排除标准:(1)近3个月服用避孕药或其他影响性激素水平及糖脂代谢药物者;(2)妊娠或疑似妊娠者;(3)有严重的内外科疾病,不能配合随访者。本研究经杭州市妇产科医院医学伦理委员会审查通过(批准文号:2023医伦审A第007号),详细告知患者研究内容及方法,并签署知情同意书。
1.2 方法
1.2.1 临床资料收集
对患者进行详细的信息采集并记录,建立健康档案,包括个人信息(年龄、文化程度、职业、经济收入、婚姻状况)、月经史、生育史、既往史、家族史等。测量身高、体重、腰围、臀围,并计算BMI和腰臀比(waist hip rate, WHR),WHR=腰围/臀围。统一采用人体成分分析仪测量患者的体脂率和内脏脂肪面积。根据2023年《多囊卵巢综合征诊治路径专家共识》评估高雄激素血症相关临床表现,包括改良费里曼-高尔威(modified Ferriman-Gallwey, mF-G)多毛评分、Rosenfield痤疮评分和Ludwig脱发评分。留取患者静脉血进行PCOS相关指标检测,同时留取粪便标本进行肠道菌群检测。
1.2.2 生活方式综合管理
患者接受为期6个月的行为-饮食-运动-情绪指导一体的生活方式综合管理治疗。(1)营养科医生根据低升糖指数原则和饮食习惯进行饮食指导,并根据干预效果及时调整,给予可完成的、动态的运动建议(运动时间和强度遵照2023年的《多囊卵巢综合征诊治路径专家共识》)。(2)妇科内分泌科医生根据患者月经情况和临床高雄激素症状进行月经调理,指导患者观察每次月经情况。所有患者均于月经周期的后半期开始口服地屈孕酮片(荷兰雅培公司,批准文号:药准字H20130110;规格:10mg×20片),10mg/次,2次/d。起始日期和治疗天数取决于个体周期长度。(3)内科医生针对患者IR、高尿酸血症、脂肪肝等个体情况进行生活方式指导。(4)心理医生对所有患者进行疾病科普,消除对疾病的恐惧、担忧和误解,增加患者配合度。在家属的共同协助下,引导患者逐步主动改掉易引起疾病的心理状态和生活习惯,代之有利于疾病治疗的心理状态和生活习惯。对焦虑、抑郁症状严重的患者进行专业心理指导。
1.3 随访及观察指标
1.3.1 随访
患者入组后每日记录体重、饮食及运动情况,并通过微信平台进行反馈。每月来院进行饮食和运动指导,测量体重、血压、心率、呼吸等,记录月经情况和减重进展。6个月后再次进行临床评估(同入组时),并留取粪便标本。
1.3.2 血清学检查
采集患者空腹静脉血,测定FPG、总胆固醇(totalcholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C)水平。于月经第2~4天或闭经期B超检查未见优势卵泡并排除妊娠时测定性激素指标,包括黄体生成素(luteinizing hormone, LH)、卵泡刺激素(follicle stimulating hormone, FSH)和睾酮(testosterone, T)水平。
1.3.3 肠道菌群检测
(1)粪便样本采集和基因组DNA提取:采用无菌冻存管收集患者粪便(取粪便中心部分约5~10g);迅速置于-80℃冰箱保存;按DNA提取试剂盒说明书在样本中提取粪便微生物总DNA。(2)样本文库构建和宏基因组测序:使用DNA超声打断350bp主带,并对400~500bp的条带进行胶回收;纯化后的打断产物进行末端补平及去磷酸化,连接华大基因测序平台(Beijing GenomicsInstitute Sequencing, BGISEQ)进行建库,使用BGISEQ进行测序。该检测委托深圳华大生命科学研究院完成。
1.3.4 生物信息学分析
(1)物种注释和基因丰度构建:依据实验室既往构建的完整肠道微生物参考基因集,对获得的宏基因组数据进行识别、组装和预测。将去除冗余基因后的基因集进行物种注释,若比对结果满足阈值(>65%为门;>85%为属;>95%为物种)则将基因分类到对应的级别(门、属或物种);将比对上某个基因的reads数量加和得到基因的丰度信息,并进行归一化处理;物种的丰度信息则由基因的相对丰度信息加和得到。(2)物种和功能分析:根据人体肠道微生物的基因组集(Unified Human Gastrointestinal Genome, UHGG)数据库将每个read进行物种分类和注释。基于物种注释和丰度结果,计算其Alpha多样性和Beta多样性,进行物种组成及样本间菌群结构的差异性分析。将基因集与京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)功能数据库进行比对,获取基因集对应的功能通路信息。
1.4 质量控制
1.4.1 准备阶段
在研究实施前进行周密的组织安排,成立研究小组,并对小组人员进行统一培训,以保证评估和干预内容的一致性、规范性。
1.4.2 实施阶段
小组人员严格按照纳入和排除标准选择研究对象,并统一建立健康档案。使用统一方法和测量工具测量研究对象的身高、体重、血压、腰围、臀围两次,取平均值。身高、体重测量时必须脱鞋,腰围、臀围测量时只准穿单衣。由固定人员在同一检查室使用同一台设备进行体成分检查。所有仪器使用前必须经过校准。高雄激素体征评估每次由两名小组人员同时进行,以减少偏倚。由小组专人进行肠道菌群的采集和质量检查,仅对符合条件的标本进行无菌冻存。
1.4.3 数据处理
所有数据均采用单人双录入方式,并由第2个人进行一致性检验,确保信息准确无误。所有的原始资料及分析过程资料都完整保存。
1.5 统计学处理
采用SPSS 25.0统计软件。正态分布的计量资料以社表示,组内治疗前后比较采用配对t检验;非正态分布的计量资料以M(P25,P75)表示,组内治疗前后比较采用Wilcoxon秩和检验。应用R语言对菌群测序数据进行分析。采用物种丰度柱状堆叠图表示不同组间不同分类水平的物种组成情况。采用Shannon指数、Simpson和Chao1指数评价菌群的Alpha多样性,并采用Wilcoxon秩和检验进行差异性分析。采用Bray-Curtis距离衡量样本间不同水平的差异,进行Beta多样性分析。采用Wilcoxon秩和检验对不同水平物种的组成差异进行比较分析。采用线性判别分析效应大小(linear discriminant analysis effect size, LEfSe)寻找最能解释组间差异的物种,并用线性判别分析(linear discriminant analysis, LDA)表示其对组间差异的影响程度,以2.0为LDA阈值。根据KEGG数据库获得不同水平上样本间的功能差异,采用Wilcoxon秩和检验对不同样本间的功能差异进行统计。P<0.05为差异有统计学意义。
2 结果
2.1 患者治疗前后临床指标比较
2.1.1 性激素水平和临床高雄激素体征比较
患者治疗后LH、LH/FSH、T水平均低于治疗前(均P<0.05),FSH水平与治疗前比较差异无统计学意义(P>0.05)。患者治疗后mF-G多毛评分较治疗前降低(P<0.05),而Ludwig脱发评分、Rosenfield痤疮评分与治疗前比较差异均无统计学意义(均P>0.05)。见表1。
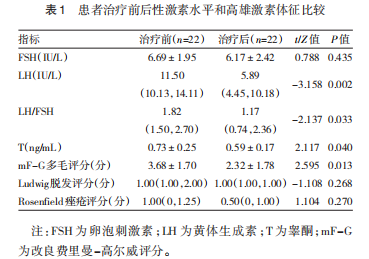
2.1.2 体重、糖脂代谢水平比较
患者治疗后体脂率和内脏脂肪面积均低于治疗前(均P<0.05),体重、bmi和whr与治疗前比较差异均无统计学意义(均p>0.05)。患者治疗后TC、LDL-C和FPG水平均低于治疗前(均P<0.05),tg、hdl-c与治疗前比较差异均无统计学意义(均p>0.05)。见表2。
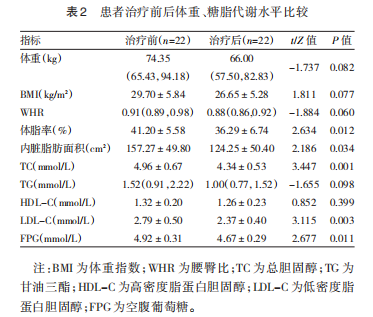
2.2 患者治疗前后肠道菌群的变化
2.2.1 物种组成分析
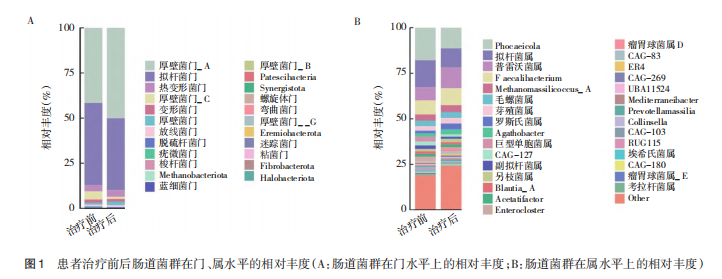
在门水平上,治疗前相对丰度最高的菌群是拟杆菌门,其次为厚壁菌门。治疗后相对丰度最高的是厚壁菌门,其次为拟杆菌门。见图1A。在属水平上,治疗前菌群相对丰度依次为Phocaeicola、拟杆菌属、粪杆菌属和普雷沃菌属。治疗后依次为普雷沃菌属、Phocaeicola,、拟杆菌属和粪杆菌属。见图1B。
2.2.2 物种多样性分析
在门水平和属水平上,治疗前后菌群的Chao1、Simpson和Shannon指数比较差异均无统计学意义(均P>0.05),这表明治疗前后肠道菌群的Alpha多样性无显著差异。在门和属水平上治疗前后的菌群Beta多样性比较差异无统计学意义(P>0.05)。
2.2.3 物种差异分析
在门水平上,治疗后梭杆菌门显著减少(P<0.05)。在属水平上,治疗后梭杆菌属、Enterocloster、Flavonifractor和Phoenicibacter呈显著降低的趋势(均P<0.05),而Angelakisella、UBA3631、CAG-884、UBA1711、CAG-353、SFFH01、CAG-302、UMGS2068、HGM10766、UBA5026、CAG-724、Phil1、CAG-1024、UBA1174、UMGS951、SFELO1、UMGS1477、UBA1417和CAG-417呈显著升高的趋势(均P<0.05),其中梭杆菌属和Flavonifractor显著性最强。
2.2.4 生物标志物种分析
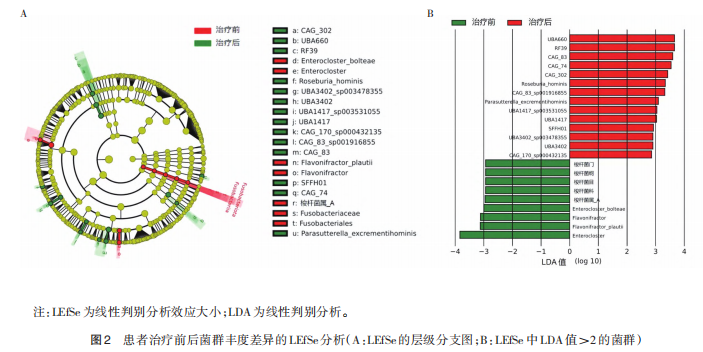
治疗前后一共有23种差异菌群,主要集中在厚壁菌门、梭杆菌门和变形菌门上,见图2。在门水平上,治疗前梭杆菌门(LDA=2.94)可作为其生物标志物种。在属水平上,治疗前Flavonifractor(LDA=3.12)、Enterocloster(LDA=3.84)和梭杆菌属(LDA=2.96)可作为其生物标志物种。治疗后UBA1417(LDA=3.03)、CAG-83(LDA=3.60)、UBA3402(LDA=2.91)和CAG-302(LDA=3.42)可作为其生物标志物种。
2.2.5 功能分析
在KEGGLevel1水平上,“代谢”通路在治疗前后显著不同(P<0.005),治疗前此通路丰度较高。在KEGGLevel2水平上,两组具有差异的通路有10条,其中丰度差异最明显的通路是“辅助因子和维生素的代谢”,且此代谢通路在治疗前的相对丰度较高。在KEGGLevel3水平上,两组具有差异的通路有30条,其中丰度差异最明显的通路是“脂肪酸代谢”,且此通路在治疗前的相对丰度较高。
3 讨论
本研究结果显示,生活方式综合管理能降低超重或肥胖PCOS患者的体脂率、内脏脂肪面积、TC、LDL-C和FPG水平,表明生活方式综合管理可有效帮助患者减脂,并改善体内的不良代谢状态。一项系统性综述表明,生活方式治疗可以降低PCOS患者血清中的胆固醇水平,从而减少雄激素合成的前体物质,使T和LH水平下降,这与本研究结果一致。在本研究中,营养科医生针对每例患者的饮食和运动习惯,为其制定了易于接受的个体化方案,这有助于提高患者的治疗信心和依从性。
经过6个月的生活方式综合管理治疗,PCOS患者体内的LH和LH/FSH水平均显著下降,T和mF-G多毛评分亦较前降低,表明生活方式综合管理有助于超重或肥胖PCOS患者高雄激素体征的改善并降低血清雄激素和LH水平。人体中的胆固醇是合成雄激素的前体物质,当体内脂代谢紊乱时,过多的胆固醇在17a-羟化酶和17,20-裂解酶的作用下生成雄激素,高水平的雄激素又进一步加重脂代谢紊乱,形成恶性循环。同时,产生的雄激素在外周脂肪组织转化为雌酮,大量的雌酮持续作用于下丘脑和垂体,使其不断分泌LH,影响卵泡发育。生活方式治疗被认为是治疗PCOS患者的一线措施。Abdolahian等在一项包括11项研究和412名参与者的荟萃分析中发现,生活方式改变可以降低青春期PCOS患者的LH和雄激素水平,这与本研究结果一致。
肠道微生物群作为宿主的“第二个大脑”,可以通过内分泌、神经、免疫等方式参与人体代谢活动。近年来发现,肠道微生物群相关的代谢途径与炎症反应、胰岛素信号传导、糖脂代谢和激素分泌有关。“肠道微生物群失调”理论中提出,肠道细菌内毒素进入血液循环可能是引发慢性炎症和PCOS的原因。高糖高脂饮食的过量摄入可能引起肠道菌群的失调,进而改变肠道代谢物的活性和含量,破坏肠道屏障的完整性,激活免疫系统和慢性炎症反应。产生的炎症细胞因子进一步损伤胰岛素受体的功能,引起HA和IR。而雄激素的过度分泌刺激内脏脂肪组织分解,导致游离脂肪酸增加,反过来加重IR。
国内外指南均推荐生活方式治疗作为PCOS的一线治疗方案。长期高脂高糖的饮食会使肠道内的有益菌减少,久之引起肠道菌群失调,诱发PCOS、糖尿病、高血压等代谢性疾病。改变饮食习惯和加强锻炼可以改善肠道菌群的丰度和种类。动物实验发现,给PCOS模型大鼠喂食亚麻籽油可以改善IR,降低血脂,调节肠道菌群。Lambert等通过分析2型糖尿病小鼠和健康小鼠的肠道微生物群发现,与静坐组相比,运动组小鼠的厚壁菌门丰度更高,而拟杆菌属和普氏菌属丰度降低。虽然之前已有研究发现生活方式治疗可以通过改变肠道菌群来降低PCOS发生的风险,但其影响PCOS的机制尚未完全清楚,值得进一步探索。
本研究发现,与干预前相比,生活方式管理后的菌群组成显著不同。在门水平,梭杆菌门在治疗后显著降低。在属水平,差异最明显的为梭杆菌属和Flavonifractor属,两者在治疗后均明显降低。
Flavonifractor属于厚壁菌门,与慢性低度炎症反应、氧化应激和肠脑轴密切相关。“微生物-肠-脑轴”是肠道细菌与中枢神经系统之间的双向通讯通路。Coello等通过比较情感障碍人群和健康人群的菌群组成后发现,情感障碍人群的肠道菌群中Flavonifractor丰度较高,这表明Flavonifractor与情绪健康有关。另一项研究发现,与健康人群相比,精神类疾病人群的肠道菌群中,促炎微生物的种类和丰度均显著增加。这表明肠道菌群可能通过诱导的炎症反应和肠脑轴参与PCOS的发生、发展,而生活方式干预可以通过改变菌群组成,降低体内的炎症反应,从而改善一系列临床症状。
梭杆菌属属于革兰阴性菌属,最常定植于人体的口腔、上呼吸道、胃肠道和女性泌尿生殖道中。作为正常菌群的一种,梭杆菌属只有在宿主免疫力低下、菌群失调的情况下诱发各类感染性疾病。近年来研究发现,PCOS患者的肠道微生物中梭杆菌门显著增加,肥胖者更甚,这可能与炎症反应、肠道屏障和内毒素血症有关。梭杆菌的促炎作用已被广泛报道。梭杆菌属可以通过炎性小体介导白细胞介素-1、白细胞介素-18等炎性细胞因子的产生,从而参与感染和组织损伤反应中的免疫调节过程。此外,梭杆菌可以侵入上皮细胞,损害肠道上皮细胞的完整性,使LPS等有毒物质进入血液形成内毒素血症,在血液中被免疫细胞表面的Toll样受体4识别并结合,从而诱导炎性细胞因子和炎症介质的表达,引发氧化应激和全身炎症反应。
本研究发现,在KEGGLevel3水平上,综合管理前后丰度差异最明显的通路是“脂肪酸代谢”。短链脂肪酸(shortchainfattyacids,SCFAs)指碳链上碳原子数在1~6之间的脂肪酸,是常见的肠道代谢物,可以调节肠道化学屏障和物理屏障,维持肠道内部环境的平衡。除此之外,SCFAs可以抑制中性粒细胞和巨噬细胞的增殖,降低炎症因子的表达,调节肠道免疫功能,减轻肠道局部炎症反应。脂肪酸代谢的改变,破坏了肠道免疫和代谢稳态,并诱导炎症形成。本研究发现,生活方式综合管理可以改善肠道菌群的菌群组成,改善脂肪酸的代谢,从而减轻PCOS患者体内的炎症情况。
除了肠道本身,SCFAs也可以通过血液循环分布到全身,影响大脑等其他器官。SCFAs可以直接或间接影响微生物-肠-脑轴。间接途径通过免疫或内分泌系统介导,而直接信号传导是SCFAs神经活性特征的结果,主要通过激活G蛋白偶联受体和抑制组蛋白脱乙酰化酶发挥抗炎作用。有研究发现,与健康对照组相比,抑郁症患者的粪便样本中SCFAs含量较低,而在摄入益生菌(包括产生SCFAs的菌株)后,研究对象的抑郁症状有所减轻,健康个体报告情绪和认知能力也得到改善,这表明SCFAs在脑部存在有利作用,其相对缺乏有助于疾病的发生、发展。
本研究样本量相对较小,不能有效排除特异性较强个体对最终实验结果的影响。本研究发现肠道菌群的组成和分布可能与PCOS患者的炎症状态有关,但是该研究未涉及临床炎症指标,同时脂肪酸代谢参加PCOS的机制有待进一步研究。在后续的研究中将扩大样本量,进一步探究生活方式管理对炎症指标以及脂肪酸通路的影响。
综上,生活方式综合管理有助于超重或肥胖PCOS患者减脂增肌、改善体内的不良代谢状况,降低雄激素和LH水平。宏基因测序结果表明,生活方式综合管理可以降低PCOS患者肠道内梭杆菌属和Fla-vonifractor属等促炎菌群的丰度,通过脂肪酸代谢通路改善PCOS的发生、发展。本研究可为之后使用益生元或益生菌治疗改善肠道菌群状态,有效治疗PCOS提供理论依据。
参考文献:略
作者:叶莎[1] 黄烨佩[2] 苏碧莎[3] 卢懿[3] 马林[1] 黄坚[1]
单位:杭州市妇产科医院妇科内分泌科[1]
浙江大学医学院附属妇产科医院超声科[2]
浙江中医药大学第四临床医学院[3]
来源:浙江医学2025年第47卷第6期
声明:
1.本网站所有内容,凡是注明 “来源:心脏康复网”的文字、图片和音视频资料,授权转载时须请注明“来源:心脏康复网”。
2.本网所有转载文章系出于学术分享的目的,版权归原作者所有。如有侵权,请及时联系我们更改或删除。