【摘要】 心率增快是高血压常见的一种临床表型。多项研究显示,心率增快很可能是一项重要的心血管危险因 素,伴随着增高的心血管事件发生率和死亡风险。心率增快的不利影响还涉及与高血压密切相关的多种内分泌、肾脏 和神经内科疾病,心率管理需要多学科临床医生共同参与。因此,高血压心率管理多学科共识组组织心血管、内分泌、 肾脏、神经、药学和循证医学等领域的专家,结合国内外最新且重要的循证资料,制定了《中国高血压患者心率管理 多学科专家共识(2021 年版)》。该共识阐述了高血压患者心率测量的方法、心率增快的原因和机制、心率增快伴随 不利后果的临床证据、心率增快的干预方法以及高血压合并 10 种特殊疾病的心率管理。共识建议将静息心率 >80 次 /min 作为高血压患者心率干预的切点,干预方法包括改善不良生活方式和使用兼有减慢心率作用的降压药物(首选选择性 β1- 受体阻滞剂)。共识还提出了简单实用的 8 条临床建议,以期为各学科医生针对不同类型高血压患者进行心率管 理提供指导意见。
【关键词】 高血压;心率;疾病管理;多学科诊疗模式;专家共识
【中图分类号】 R 544.1 R 331.31
【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2021.00.557
高血压心率管理多学科共识组 . 中国高血压患者心率管理多学科专家共识(2021 年版)[J].中国全科医学,
心率增快是高血压常见的一种临床表型。法国 10 万人群的调研发现,未治疗的高血压患者平均心 率较正常血压者增快 6 次 /min[1]。2014 年,我国 21 个城市 115 229 例高血压患者的横断面调查显示,我 国高血压患者的静息平均心率为 76.6 次 /min,单纯 高血压患者中心率≥ 80 次 /min 者占 38.2%[2]。这 与意大利的一项研究结果相似,后者显示高血压患 者中 30% 以上静息心率≥ 80 次 /min[3]。近年来, 高血压伴心率增快患者的心率管理问题逐渐受到重 视,因为在不同人群中进行的诸多流行病学研究显 示,心率增快很可能是一项重要的心血管危险因素, 可增加心血管事件和死亡风险。
2017 年我国发表《高血压患者心率管理中国专家共识》,专家们针对心率增快是否导致靶器官损害、如何界定心率增快等问题逐个进行讨论,提出了针 对我国高血压患者心率管理的共识性建议[4]。最近 3 年,在心率检测技术、心率增快机制以及心率增快 的不利后果等方面均有较多新的、重要的研究结果 发表,尤其是我国学者的大样本研究弥补了国内既 往循证资料的不足[5-6]。此外,越来越多的研究发现, 心率增快的不利影响还涉及与高血压密切相关的多 种内分泌、肾脏和神经内科疾病,心率管理需要多 学科临床医生的参与。因此,我们决定撰写《中国 高血压患者心率管理多学科专家共识(2021年版)》。
1 高血压患者心率测量
1.1 心率测量方法
心率可通过脉搏触诊、心脏听 诊、电子血压计、心电图、动态心电图或动态血压 等进行测量。心律失常尤其心房颤动时,脉搏触诊、 电子血压计或动态血压测量均可能造成误差,因此, 推荐通过心脏听诊计数心率。心房颤动患者的心脏 听诊时间应持续至少 1 min。
1.2 心率测量方式
1.2.1 诊室心率 通过脉搏触诊、心脏听诊计数心 率。影响心率的因素包括生理因素、心理因素、环 境和体位等。为最大限度地减少上述因素的影响, 测量静息心率应规范化(见表 1[7])。诊室心率是 最常用的心率测量方式,因此,本共识中的静息心率一般指在诊室中测量所得。

1.2.2 家庭自测心率家庭自测心率与诊室心率和 24 h 平均心率的相关性良好[8]。建议患者在使用家 庭自动血压计测量血压的同时记录心率,尽可能在清晨安静状态下自测心率,测量时的注意事项可参考表 1。家庭自测心率有可能为临床提供更多有价值的信息,避免白大衣效应,但家庭自测心率与不良事件关系的研究有限。HOZAWA 等[9]报道,家庭自 测心率每增加 5 次 /min,心血管疾病死亡风险增加 17%(P=0.004,平均随访 10.5 年)。
1.2.3 动态心率监测 可通过 24 h 动态心电图和动态血压测量获得。与诊室心率相比,动态心率能为临床提供更多有价值的信息,包括心率的昼夜节律 变化、心率变异性、夜间心率,避免白大衣效应[10]。 多项研究显示,高血压或普通人群的 24 h 平均心率 与诊室心率比较差异无统计学意义,但也有研究发 现 24 h 平均心率低于诊室心率。例如,在 807 例老 年单纯收缩期高血压患者中,24 h 平均心率较诊室心 率慢(3.8±8.0)次 /min(P<0.001)[11]。 夜间心率过快通常反映夜间交感神经活性增强, 夜间平均心率对心血管事件和死亡风险的预测价值 优于白天平均心率[10,12]。而清晨血压升高和心率增 快,可能增加心脑血管事件发生风险。
1.2.4 可穿戴心率检测设备 近年来可穿戴医疗设 备发展迅速。通过采用光学体积描记等技术,多种智 能手机、手表和手环均能提供在静息和运动状态下实 时监测心率的功能。初步研究显示这些可穿戴设备的 心率测值与同步心电图记录的数据一致性良好[13-14], 但其临床应用价值还需要进一步研究。
2 心率增快的原因和机制
2.1 生理性 生理性窦性心动过速较常见,运动、 体位改变、焦虑、情绪激动、妊娠、饮酒、饮用咖啡、 饮茶、吸烟等均可使心率增快。
2.2 药物性 阿托品、苯丙胺等副交感神经阻断药 物,肾上腺素、麻黄素等拟交感神经药物,丙米嗪、 阿米替林等三环类抗抑郁药,以及左西孟旦、米力 农、氨茶碱、短效硝苯地平,或突然停用 β- 受体 阻滞剂等均可引起心率增快。有研究报道,胰高血 糖素样肽 1(glucagon-like peptide 1,GLP-1)受体激动剂利拉鲁肽等可增快 2 型糖尿病患者的静息心率, 其机制可能与窦房结中 GLP-1 受体激活或交感神经 活性增强有关[15-16]。
2.3 病理性 贫血、疼痛、感染、发热、甲状腺功 能亢进、低血糖、嗜铬细胞瘤、低血压、休克、肺栓塞、 慢性阻塞性肺疾病以及多种心血管疾病如急性心肌 梗死、心力衰竭、心肌炎、心包炎或心肌病等均可 引起心动过速。 对于静息心率增快的高血压患者,应注意排除上 述引起心率增快的原因,再考虑是否对静息心率增 快进行干预。
2.4 心率增快与心血管事件相关的病理机制 流行 病学研究显示,心率与心血管事件的相关性,在进 行临床验证之前,首先要有发病机制方面的合理解 释[7]。最新研究显示,与健康人相比,高血压患者 整体及心脏去甲肾上腺素溢出量均显著增加,心脏 去甲肾上腺素溢出量与心率快慢呈高度相关(r=0.82, P=9.3×10-5 )[17]。这些结果证实高血压患者处于交 感神经激活状态,心率增快是心脏交感神经活性增 强的生物标志物。心率增快提示交感和副交感平衡 失调,由此可导致血压升高,进而损害心脏功能; 这些改变又会使心率增快。高血压和交感神经兴奋 互为因果。 心率增快还可直接损伤动脉、心脏及其他靶器官。 例如,在动物实验中,长期心率增快可增加动脉管 壁切应力,后者通过诱导内皮基因表达和影响细胞 信号通路,导致血管氧化应激、内皮功能异常和管 壁结构改变[18]。心率增快还伴随着心肌耗氧量增加、 动脉粥样硬化加速、代谢异常(胰岛素抵抗、血脂 异常和肥胖)以及触发心律失常等[19](见图 1)。 因此,高血压患者的心率管理需要多学科临床医生的共同参与和努力。
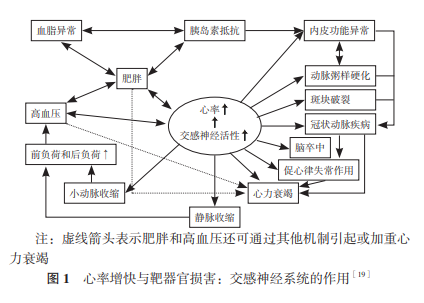
3 高血压患者需要心率管理的证据
3.1 心率增快与高血压发生率和靶器官损害的关系
日本一项研究将4331 例血压正常的成人按基线心 率的快慢等分为四组,随访 3 年后心率较快组(≥ 71 次 /min)与心率较慢组(<58 次 /min)比较,高血压 发生率增加 61%(P<0.05)[20]。意大利 HARVEST 研究对1103 例未接受治疗的 1 级高血压患者平均随 访 6.4 年,发现基线心率≥ 85 次 /min 者发生持续性 高血压的相对危险是心率 <85 次 /min 者的 2 倍[21]。 还有研究显示,基线心率增快可加重高血压患者的 主动脉僵硬程度[22]或增加微量白蛋白尿[23]。
开滦队列研究将31507 例非高血压成人(其中 男性 23 298 例)按基线心率分为心率≤ 66 次 /min、 67~71 次 /min、72~77 次 /min 和≥ 78 次 /min 四组, 平均随访 3.53 年后,四组受试者高血压发生率分别 为 104.4/1 000 人 年、109.7/1 000 人 年、114.2/1 000 人年和 124.6/1 000 人年(P<0.000 1);静息心率每 增快 10 次 /min,新发高血压的风险增加 8%[24]。
中国农村队列研究对 9 969 例正常血压的 18 岁 以上成人平均随访 6.01 年,发现在基线静息心率较 慢(≤72次/min)、中等(73~80次/min)和较快(≥81 次 /min)的女性中,高血压发生率分别为 19.13%、 19.83% 和 19.61%;校正混杂因素后,与心率较慢者 相比,心率中等和较快者发生高血压的危险比分别 为 1.09〔95%CI(0.95,1.24)〕和 1.19〔95%CI(1.04, 1.36)〕。而在男性中则未发现静息心率与高血压发 生率有显著相关性[25]。
3.2 心率增快与心血管事件和全因死亡率的关系
迄今为止,已有 14 项研究在高血压患者中评价了静 息心率与心血管事件或死亡率的关系[5-6,11,26-36], 其中 13 项研究显示心率与不利后果呈阳性相关(见 表 2)。
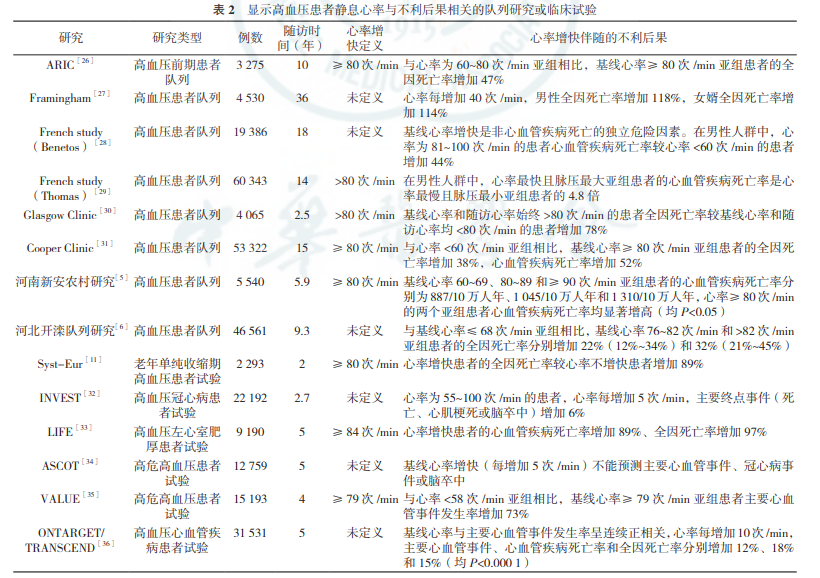
我国 2 项大样本的高血压患者长期随访队列 研究同样发现,在校正各种混杂因素后,基线心率 增快(≥ 80 次 /min)的患者心血管疾病死亡率和全 因死亡率均显著增高[5-6]。因此,国内外的真实世 界研究结果非常相似。
尽管迄今为止尚缺乏前瞻性的以心率作为干预靶 点对临床终点影响的药物试验,也缺乏高质量的前 瞻性随机对照试验证实减慢心率本身即能带来显著 的临床获益,但从流行病学角度来看,心率增快可 视为一项独立的心血管危险因素[3,7]。因此,对心 率增快的高血压患者予以适当的药物干预是合理的。
4 高血压患者心率干预的切点
传统上正常窦性心律的定义为 60~100 次 /min。 但这一定义只是早年专家们的一种共识,没有经过 任何科学验证[37-38]。临床研究显示,在 60~100 次 /min 范围内,较快的心率会显著增加高血压患者的心血 管事件和死亡率[5-6,30-33]。因此,以静息心率<100 次 /min 作为高血压患者的心率干预切点并不合适。
在多项队列研究和临床试验中,静息心率增快的 定义为 >80 次 /min,心率 >80 次 /min 的高血压患者 心血管事件发生率和死亡率均显著高于心率相对较 慢者(见表 2)。韩国一项针对 6 100 例 55 岁以上社 区居民随访 20.8 年的队列研究发现,静息心率增快 与高血压协同增加心血管事件:与心率 61~79 次 /min 的正常血压者相比,心率≥ 80 次 /min 的男性中重度 高血压患者心血管疾病死亡危险比为 8.34〔95%CI (2.52,28.19)〕,女性危险比为 5.95〔95%CI(1.59, 22.97)〕[39]。我国一项高血压社区管理项目纳入 了 205 900 例高血压患者,结果显示这些患者的平均 收缩压和舒张压均随心率增快而升高(P<0.001), 心率 60~79 次 /min 的患者平均血压水平最低且血压 达标率最高[40]。
GRASSI 等[41]采用间接(测定静脉血浆去甲肾 上腺素)和直接方法(用微神经图记录骨骼肌交感神 经冲动释放量)评价 193 例未接受降压治疗的轻中 度高血压患者交感神经活性,结果发现,与静息心 率<80 次 /min 组相比,静息心率≥ 80 次 /min 组患 者的血浆去甲肾上腺素水平显著增高〔(293.0±8.7) ng/L vs.(254.1±8.9)ng/L,P<0.002〕、 交 感 神 经 冲 动 释 放 量 显 著 增 加〔(72.77±0.9) 次 /min vs.(36.83±1.3)次 /min,P<0.000 1〕,提示静息心 率≥ 80 次 /min 的高血压患者处于交感神经过度激活 状态。
欧洲高血压学会专家组认为,根据现有的流行病 学数据,高血压患者和普通人群的心率干预切点为 80~85 次 /min[7]。本共识专家组综合分析现有循证 医学证据,参考欧洲高血压学会的意见,建议将我国 高血压患者的心率干预切点定义为静息心率 >80 次 /min。本共识还建议,高血压患者在静息状态下不同 时间点的多次家庭自测心率均 >75 次 /min,也可视 为心率增快。
5 高血压患者心率管理的干预方法
(1)首先应排查高血压患者心率增快的诱因和 原因,包括生理性、药物性、心血管疾病或全身性疾病(见前述),对此应针对影响因素及原发疾病 予以纠正和治疗。
(2)对高血压伴心率增快患者,需改善不良的 生活方式,如久坐、高盐饮食、吸烟、酗酒,大量 饮用咖啡和浓茶会促进交感神经兴奋而使心率增快。 建议要有计划、渐进性地增加体育锻炼和有氧运动, 控制体质量,提高身体素质和运动耐力。应积极倡 导控盐(食盐摄入量<6 g/d)、不吸烟和不酗酒,心 率较快者也不宜大量饮用咖啡或浓茶。
(3)高血压伴心率增快患者的药物治疗,首选
兼有减慢心率和降低交感神经兴奋性作用的抗高血
压药物 β- 受体阻滞剂。β- 受体阻滞剂主要分为 3
类(见表 3):第 1 类为非选择性 β- 受体阻滞剂,
代表药物有普萘洛尔,因阻断 β2 受体,不良反应多,
且系短效药,已很少用于高血压的治疗;第 2 类为
选择性 β1- 受体阻滞剂,国内主要代表药物有美托
洛尔(美托洛尔平片和美托洛尔缓释片)、比索洛
尔和阿替洛尔,既往临床研究证实阿替洛尔心血管
保护作用较弱[42],故高血压伴心率增快患者的治疗,
首先推荐在临床试验中证实有心血管保护作用的选
择性 β1- 受体阻滞剂美托洛尔缓释片和比索洛尔;
第 3 类为同时作用于 β 和 α1 受体的阻滞剂,主要
药物有卡维地洛、阿罗洛尔和拉贝洛尔,拉贝洛尔为
短效降压药物,每日需口服 2~3 次,因其对胎儿生
长发育的不良影响很小,故常用于治疗妊娠高血压。

(4)高血压伴心率增快的另一类常用降压药 物为非二氢吡啶类钙通道阻滞剂(calcium channel blocker,CCB,见表 3),该类药物阻断心肌细胞 L 型钙通道,具有负性肌力、负性传导和负性频率作用, 减慢心率但不抑制交感活性。因此,交感活性增强 的心率增快患者应首选 β- 受体阻滞剂,不能耐受 β- 受体阻滞剂或非交感激活的心率增快患者则选择 缓释的非二氢吡啶类 CCB。
(5)If 通道阻滞剂伊伐布雷定,可减慢心率, 对血压基本无影响。对于不能耐受 β- 受体阻滞剂 和非二氢吡啶类 CCB 的高血压伴心力衰竭或冠心病 患者,可以考虑应用伊伐布雷定。
高血压患者首先应控制血压达标,在降压治疗的 同时注重心率管理。常用的 5 大类降压药物均可用于 初始治疗、单药治疗和联合治疗,建议根据患者的临 床特点针对性选择药物,进行个体化治疗。对心率增 快者优先推荐 β- 受体阻滞剂,血压未达标者 β- 受 体阻滞剂可联合二氢吡啶类 CCB;对使用 CCB 后心 率增快而血压未达标者可以联合 β- 受体阻滞剂, 必要时还可联合其他类别降压药物,直至血压和心 率均达标。在达标方面优先推荐单片固定复方制剂, 我国现有的 β- 受体阻滞剂和二氢吡啶类 CCB 的单 片固定复方制剂为尼群洛尔片。
6 高血压合并特殊疾病的心率管理
6.1 高血压合并心力衰竭 积极降压达标能够预 防或推迟心力衰竭的发生及发展,血压应控制在<130/80 mm Hg(1 mm Hg=0.133 kPa)。 高 血 压 合 并心力衰竭患者早期多表现为射血分数保留的心力 衰 竭(heart failure with prese rved ejection fraction, HFpEF),也可(尤其在合并冠心病时)表现为射 血 分 数 降 低 的 心 力 衰 竭(heart failure with reduced ejection fraction,HFrEF)。
对于窦性心律的 HFrEF 患者,在血压能耐受的 情况下,建议控制静息心率<70 次 /min,首选 β- 受 体阻滞剂(比索洛尔、美托洛尔缓释片或卡维地洛), 无法达到靶心率或不能耐受 β- 受体阻滞剂的患者, 推荐选用伊伐布雷定[43-46],以期进一步降低心力衰 竭住院率和心血管疾病死亡率。
对 HFpEF 患者,目前采用针对病因、症状、合 并症和危险因素的综合性治疗。少数 HFpEF 患者存 在心率储备降低(即心脏变时功能不全,运动时心 率不能相应增加),这些患者应用 β- 受体阻滞剂 宜从小剂量开始,观察患者适应情况[47-48]。对于大 多数 HFpEF 患者,β- 受体阻滞剂仍然是血压和心 率管理的优选药物之一[43,49],尤其适用于伴有窦性 心动过速、快心室率的心房颤动或劳力性心绞痛的 HFpEF 患者。
6.2 高血压合并心房颤动 高血压心脏病合并慢性 心房颤动应遵循相应心房颤动指南治疗[50-52]。心 室率控制是心房颤动管理的主要策略之一,可明显 改善患者症状。常用药物有 β- 受体阻滞剂、非二 氢吡啶类 CCB、洋地黄类等。急性期心室率控制一 般需要静脉用药,可选择美托洛尔、艾司洛尔或地 尔硫 ,合并急性心力衰竭的患者可选择胺碘酮或 去乙酰毛花苷,控制心室率<110 次 /min,症状仍明 显者可控制至 80~100 次 /min。长期心室率控制首选 β- 受体阻滞剂,如美托洛尔缓释片或比索洛尔,不 合并 HFrEF 的患者也可使用非二氢吡啶类 CCB,合 并 HFrEF 的患者常联合使用 β- 受体阻滞剂和地高 辛。心率控制的初始目标是静息心室率 <110 次 /min, 仍有症状、HFrEF 或接受心脏再同步化治疗的患者 可将心室率降至 <80 次 /min。
6.3 高血压合并冠心病 建议将稳定性冠心病患者 的静息心率控制在 55~60 次 /min[53-54]。心率控制在 此范围,有助于降低心肌耗氧量,改善心肌缺血,稳 定动脉粥样硬化斑块。推荐使用无内在拟交感活性 的高选择性 β1- 受体阻滞剂,该类药物不仅可以改 善症状,而且有可能改善冠心病患者的预后。对不 能耐受 β- 受体阻滞剂或存在 β- 受体阻滞剂禁忌 证的患者,可以选择非二氢吡啶类 CCB(无该类药 物禁忌证时)。劳力性心绞痛患者经 β- 受体阻滞 剂或非二氢吡啶类CCB治疗后心率仍然无法控制时, 可以考虑使用伊伐布雷定,尤其适用于合并 HFrEF 的患者[55]。
6.4 高血压合并急性主动脉夹层 积极控制血压和 降低心室收缩力,在防止夹层假腔扩张和撕裂的前 提下,尽可能保证组织器官灌注。急性期尽早将收 缩压控制在 100~120 mm Hg,心率控制在 50~60 次 /min[56-58]。治疗药物首选 β1- 受体阻滞剂(口服或 静脉给药),联合应用乌拉地尔、硝普钠等血管扩 张剂。对于不同类型的主动脉夹层应注意差异化和 个体化治疗。
6.5 高血压合并甲状腺功能亢进症 心动过速、心 悸见于大多数甲状腺功能亢进症患者,心率通常为 100~120 次 /min,严重者可达 120~140 次 /min,发生 甲状腺功能亢进危象时心率更快。国内外指南均推荐 将 β- 受体阻滞剂用于有症状的甲状腺功能亢进症 患者,尤其是老年患者、静息心率 >90 次 /min 或同时存在心血管疾病的患者[59-60]。除控制心率外,β-受 体阻滞剂还能减轻甲状腺毒症相关症状如心悸、震 颤、怕热、肌无力等,同时改善易怒、情绪不稳和 运动不耐受。β- 受体阻滞剂可选择普萘洛尔、美托 洛尔平片、美托洛尔缓释片或阿替洛尔,重症或甲 状腺功能亢进危象患者可使用艾司洛尔。对于 β- 受 体阻滞剂不耐受或存在禁忌证的患者,可使用非二 氢吡啶类 CCB 如维拉帕米或地尔硫 。
6.6 高血压合并糖尿病 糖尿病患者常伴有心率增 快,心率增快伴随着全因死亡率和心血管事件发生 率增高[61-62]。糖尿病患者心率增快的原因包括心脏 自主神经病变和迷走 - 交感神经活性平衡失调[63]。 糖尿病患者的静息心率以维持在 60~70 次 /min 较理 想[64],应用选择性 β1- 受体阻滞剂或对糖代谢影 响较小的 β 和 α1 受体阻滞剂。
6.7 嗜铬细胞瘤和副神经节瘤 嗜铬细胞瘤和副神 经节瘤确诊后应及早行手术治疗,首选 α- 受体阻 滞剂做术前准备,控制高血压。应用 α- 受体阻滞 剂后若患者出现心动过速,则再加用 β- 受体阻滞 剂控制心率。值得注意的是,绝对不能在未服用α-受 体阻滞剂之前使用 β- 受体阻滞剂,否则可导致高 血压危象、急性肺水肿和左心衰竭的发生[65-66]。患 者如需停药,也应先停用 β- 受体阻滞剂、再停用 α- 受体阻滞剂。
6.8 高血压合并肥胖 肥胖与高血压关系密切。研 究显示在超重和肥胖患者中,肌肉交感神经活性明显 增强,并与体质指数、腰臀比和诊室血压均呈显著 正相关[67]。在中国人群中,静息心率增快与高血压 前期和高血压的发生率显著相关,并且合并腹型肥 胖会进一步增强这种关联[68]。β- 受体阻滞剂是肥 胖相关性高血压患者常用降压药物之一,用于肥胖的 高血压患者时,降压效果较在正常体质量的高血压 患者中更强[69]。建议使用 β 和 α1 受体阻滞剂如 阿罗洛尔或卡维地洛[70],或使用高选择性 β1- 受 体阻滞剂如美托洛尔缓释片和比索洛尔。
6.9 高 血 压 合 并 慢 性 肾 脏 病(chronic kidney disease,CKD) CKD 患者常存在交感神经激活, 且交感活性随着肾功能降低而进行性增高,伴随着 心血管、代谢和肾脏病变的加速进展[71]。β- 受体 阻滞剂可安全地用于各种程度肾功能异常的 CKD 患 者,观察性研究还提示 β- 受体阻滞剂能显著降低 透析患者的心血管事件发生率和全因死亡率[72-75]。 中华肾脏病学会的指南指出,阿罗洛尔等 β 和 α1 受体阻滞剂对 CKD 合并高血压患者具有独特的应用 价值[76]。然而,关于 CKD 患者心率控制的目标值 目前缺乏研究,也没有相关的建议标准。根据一般 人群以及有限的 CKD 患者的研究结果,本共识专家 组建议CKD患者的静息心率应控制在80次/min以下。
6.10 高血压合并脑卒中 高血压合并出血性或缺血 性脑卒中的急性期,可出现交感神经与副交感神经 功能失衡,即交感神经兴奋性相对增高,由此导致 心率改变,临床表现为快速心律失常为主、或快慢 交替的心率变化,此时心率干预切点或目标为维持 循环功能稳定。 进入脑卒中的恢复期后如果仍然存在心率异常, 可按脑卒中二级预防方案进行干预。一项有效避免 再次卒中预防策略试验(PRoFESS)的事后分析,将 20 165 例新近发生缺血性脑卒中的患者按基线静息 心率的快慢分为 5 个亚组,平均随访 2.4 年,结果显 示,随着静息心率增快,患者的认知功能显著下降 而死亡率显著升高;与心率<65 82="" min="">82 次 /min 亚组患者全因死亡率 分别增加 42% 和 74%(P<0.000 1)[77]。因此,缺 血性脑卒中患者的静息心率也应控制在 <80 次 /min。高血压相关疾病患者心率管理的推荐建议见表 4。

高血压患者的心率管理流程见图 2。
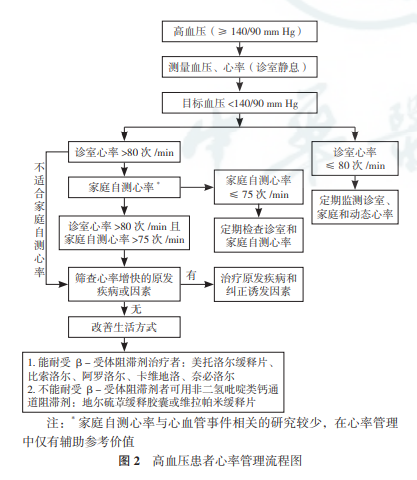
无心血管并发症(心力衰竭或冠心病)的高血压患者,首先强 调血压达标,兼顾考虑心率管理。为确定高血压水 平或是否静息心率增快,应基于非同日 3 次测量血压和心率的结果。
7 国外指南和专家共识的观点及建议
(1)欧洲高血压学会 2006 版《高血压伴心率增 快患者管理共识》中,已有 4 项研究显示了高血压患 者心率增快伴随着心血管事件和死亡率增高,静息 心率增快能独立预测心血管疾病死亡率[78]。欧洲高 血压学会 2016 更新版的《高血压伴心率增快患者管 理共识》中,已有 12 项研究评价了高血压患者心率 增快与心血管事件和死亡率的关系,大多数研究将 静息心率 >80~85 次 /min 定义为心率增快。这些研究 令人信服地证实了心率增快是心血管疾病的重要危 险因素。尽管还没有随机试验证实药物干预的获益, 但在临床实践中对有症状的心率增快患者可考虑使 用减慢心率的药物,首选 β1- 受体阻滞剂[7]。
(2)欧洲心脏病学会 / 欧洲高血压学会 2018 版 高血压管理指南中,将静息心率增快(>80 次 /min) 列为增加高血压患者心血管事件的独立危险因素之 一,并要求在每次测量血压时同步记录心率[79]。
(3)印度 2019 版心率与高血压的专家共识中提9 点建议,其中几点可供参考:①尽管高血压患者 的靶心率尚不清楚,但建议使用 β- 受体阻滞剂将 静息心率降至<70>80~85次/min)可使用心脏选择性β1-受体阻滞剂。 选择既能减慢心率,又能同时降低外周动脉血压和 中心动脉压的 β- 受体阻滞剂,心率降低≥ 10 次 /min 就有可能获益[80]。
(4)国际高血压学会 2020 版高血压实践指南中,将心率 >80 次 /min 列为高血压患者的危险因素 之一[81]。
8 临床建议
(1)高血压患者首先强调控制血压达标,兼顾 心率管理。
(2)所有高血压患者在血压测量的同时应测量 诊室静息心率,测量前至少休息 5 min,心脏听诊和 脉搏触诊计数心率时的测量时间不应短于 30 s,心房 颤动患者的心脏听诊时间应持续至少 1 min。
(3)在诊室静息心率 >80 次 /min 时,建议患者 进行家庭静息心率测量,以除外白大衣效应。
(4)我国高血压患者的心率干预切点定义为静 息心率 >80 次 /min。对高血压合并冠心病、心力衰 竭或主动脉夹层患者,应按照相应指南将心率控制至靶心率(见表 4)。
(5)对于高血压伴静息心率增快的患者,应首 先排查引起心率增快的基础疾病及其他因素,如存 在,宜首先针对原发疾病和诱发因素进行治疗。
(6)高血压伴心率增快的患者应进行有效生活 方式干预。
(7)对高血压伴静息心率增快者,尤其是合并 冠心病、心力衰竭、主动脉夹层及快速心房颤动(伴 心室率增快)的患者,可选择兼有降压和控制心率作 用的药物,如 β- 受体阻滞剂,不能耐受 β- 受体 阻滞剂者可用非二氢吡啶类 CCB(HFrEF 患者禁用)。 应注意药物的不良反应和禁忌证。
(8)优先推荐心脏高选择性长效 β1- 受体阻滞 剂(如比索洛尔、美托洛尔缓释片),对肥胖、血 糖增高和血脂异常患者推荐使用 β 和 α1 受体阻滞 剂(如阿罗洛尔、卡维地洛)。
作者贡献:
施仲伟教授负责全部共识稿件的执笔撰写及修改;
孙宁玲教授对共识的内容及终稿负责, 并协调不同学科专家参与共识讨论。
本文无利益冲突。
声明:
1.本网站所有内容,凡是注明 “来源:心脏康复网”的文字、图片和音视频资料,授权转载时须请注明“来源:心脏康复网”。
2.本网所有转载文章系出于学术分享的目的,版权归原作者所有。如有侵权,请及时联系我们更改或删除。