心房颤动(atrial fibrillation,AF)是最常见的心律失常之一。根据2016年欧洲心脏病学会(European Society of Cardiology,ESC)的AF管理指南,世界范围内20岁以上人口的患病率约为3%,其中男性和女性AF患者数量分别约为2090万人与1260万人。近50年来,年龄标准化校正后AF的患病率增加了4倍,发生率增加了3倍以上。2018中国心血管病报告显示,我国心血管疾病患者已达2.9亿人,其中AF患者超过1000万人,预计到2045年会超过2500万人。AF的常见症状包括心悸、乏力、胸闷和运动耐力下降等,且能使卒中风险增加5倍,心衰风险增加3倍,死亡和痴呆风险增加2倍。
AF患者的病理生理学特点表现为原有的规则有序的心房电活动消失,代之以快速无序的颤动波,导致心房失去有效的收缩与舒张,使得心房泵血功能恶化或丧失,进而引起心室节律(率)紊乱、心功能受损和心房附壁血栓形成等。AF患者与心衰或心梗后患者类似,容易发生身体活动功能障碍、精神和躯体健康受损以及生存质量和运动耐力下降。研究显示AF患者运动耐力下降,其峰值摄氧量(peak-VO2)较经年龄和性别校正的预计值低,但是其运动病理生理学特征尚未完全清楚。
心肺运动试验(cardiopulmonary exercise testing,CPET)是利用人体外呼吸与内呼吸耦联原理,通过运动激发受试者增加吸入O2和排出CO2,同时应用O2和CO2快速反应传感器来检测静息、运动和恢复状态下每次呼吸的O2耗量和CO2呼出量等气体代谢的测试技术,能精确测定运动状态下外呼吸与内呼吸的气体代谢异常。因此,CPET是在运动状态下综合性评估患者心脏、肺部以及骨骼肌功能的无创检查方法,能客观定量地个体化评价心脏储备功能和运动耐力。
本研究通过检测和分析CPET的核心指标来探讨AF患者的运动病理生理特征,为加深对AF患者运动病理生理学的理解及制定AF患者有氧运动的康复方案提供理论基础。
一、对象与方法
1.1 研究对象
本研究为回顾性研究,从2018年9月至2021年4月期间在中国医学科学院阜外医院进行CPET的数万例患者中筛选出156例持续性AF患者,入选标准符合2006年ACC/AHA/ESC房颤指南的定义及分类诊断标准。剔除AF射频消融术手术患者20例,最后入组AF患者共计136例。其中男性114例,女性22例,平均年龄为(54.74±10.91)岁。将无疾病诊断的正常人35人设为对照组,其中男性23例,女性12例,平均年龄为(36.57±7.85)岁。同时依据AF患者是否存在心力衰竭(heart failure,HF)将AF组分为两个亚组:AF无HF(AF-NHF)患者39例(28.7%),AF伴HF(AF-HF)患者97例(71.3%)。心衰患者的临床症状、体征和心脏超声等均符合《中国心力衰竭诊断和治疗指南2014》诊断标准。心功能根据 NYHA 分级分为Ⅰ—Ⅳ级:Ⅰ级:患有心脏病,日常活动量不受限,一般活动不引起心悸、呼吸困难等症状;Ⅱ级一般活动下出现疲乏、心悸、呼吸困难等症状,体力活动轻度受限,休息时无自觉症状;Ⅲ级活动程度小于一般活动即可出现上述症状,体力活动明显受限;Ⅳ级休息时也可发生心力衰竭症状,无法从事任何体力活动。所有受试者均签署知情同意书,并完成功率递增的症状限制性极限运动CPET。
1.2 CPET设备定标与质控
CPET使用心肺运动测试系统,每天检测前均需通过气体容量定标、高中低流速定标、气体(空气、O2和CO2)定标以及代谢模拟器定标,定标全部通过后方可对受试者进行测试。
1.3 CPET规范化操作
告知患者运动方案、设备和蹬车转速,将功率自行车高度及座椅调至受试者最舒适的位置,帮助患者佩戴好咬口器(运动期间保证其不漏气),按照Harbor-UCLA医学中心标准化CPET操作方式进行对各项指标的全程监测记录。操作医师将根据患者一般情况和基础疾病的不同及严重程度选择合适的功率递增速率。运动方案为:静息3min,热身3min,递增负荷功率(10—60W/min)直至症状限制最大极限运动状态,恢复5min。在整个运动过程中,患者全部状态将受到操作医师的严密监测。
1.4 CPET核心指标计算原则
从CPET系统中导出所有测定指标的每次呼吸(breath-by-breath)原始数据进行每秒切割(second-by-second),再用其10s平均数值制作孙氏新9图。无氧阈值(anaerobic threshold,AT)通过V-slope法检测。按照标准计算原则计算静息、热身、AT、峰值和恢复期的指标并进行分析。
1.5 CPET核心参考指标
将患者及正常人经心肺运动试验后所得到静息、热身、AT、峰值和恢复等五个时期的各项指标进行比较。具体的指标包括心率(HR)、收缩压(SBP)、舒张压(DBP)、VO2、每分钟通气量(VE)、潮气量(VT)、氧脉搏(VO2/HR)、呼吸频率(RR)、动脉血氧饱和度(SaO2)、peakVO2、AT、摄氧通气效率峰值 平 台(OUEP)、二 氧 化 碳 排 出 通 气 斜 率(VE/VCO2slope)、二氧化碳排出通气比值最低值(lowest ·VE/VCO2)等
1.6 统计学分析
本研究使用SPSS26.0进行统计分析,连续变量以均数±标准差表示。两组间连续变量采取独立样本t检验方法进行统计分析;多组间比较采用单因素方差分析,方差齐性采用F检验,组间多重比较方差齐时采用LSD检验,方差不对齐时采用Dun-nettT3检验,P<0.05为差异有显著性意义;单因素之间的相关性分析采用Spearman相关分析。采用GraphPadPrism9.0绘制线图。P<0.05表示差异有显著性意义。
二、结果
2.1 受试者一般资料
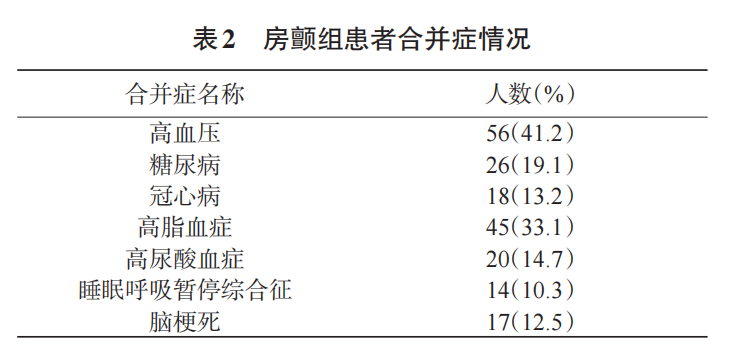
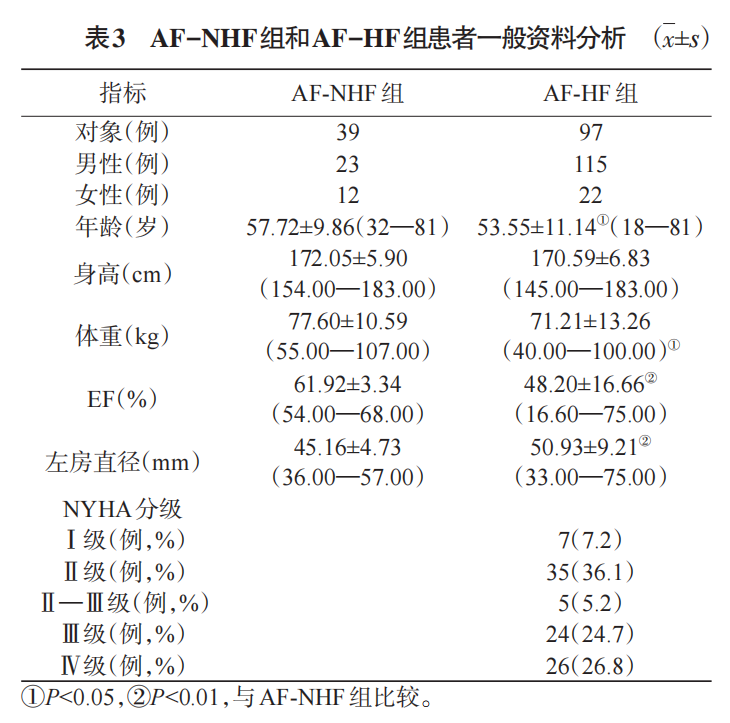
共136例AF患者完成了CPET,其中男性114例(83.2%),女性22例(16.8%)。患者年龄范围是18—81岁,平均年龄为(54.74±10.91)岁,见表1。AF患者的合并症情况见表2。其中AF-NHF组39例,AF-HF组97例。AF-HF组中,NYHA分级Ⅰ级患者7例(7.2%),Ⅱ级患者35例(36.1%),Ⅱ—Ⅲ级患者5例(5.2%),Ⅲ级患者24例(24.7%),Ⅳ患者26例(26.8%)。AF-HF组射血分数为(48.20±16.66)%,显著低于AF-NHF组(61.92±43.34)%(P<0.01);左房直径为(50.93±9.21)mm,显著大于AF-NHF组(45.16±4.73)mm(P<0.01)。AF组各患者均根据中国AF诊疗指南及相应疾病的中国指南进行AF及各种并发症疾病的治疗,患者病情稳定,见表3。
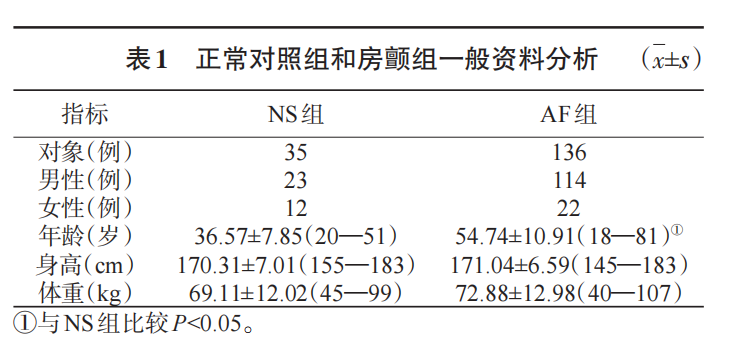
选取无任何心肺等重要脏器疾病诊断的健康人35例作为正常对照组(NS组)。其中男性23例(65.7%),女性12例(34.3%),男性比例低于AF组;NS组研究对象年龄范围是20—51岁,平均年龄为36.57±7.85岁,显著低于AF组患者(P<0.05)。身高、体重与AF组相比均无显著性差异。
2.2 CPET核心指标结果的分析比较
2.2.1 AF组与NS组CPET核心指标结果的比较
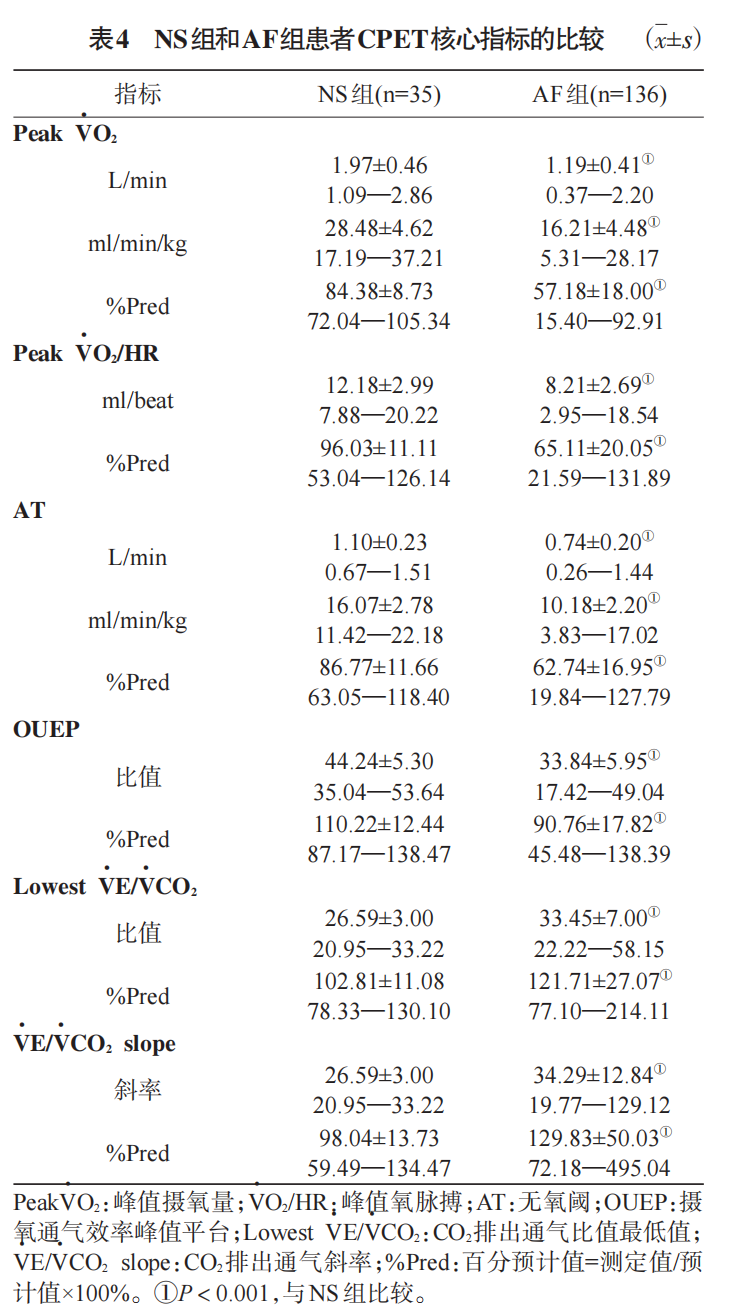
AF组患者心肺运动整体功能指标中, AT、peakVO2/HR实测值和百分预计值均显著低于NS组(P<0.001),提示AF患者的心肺运动整体功能状态显著异常。VE/VCO2slope、lowestVE/VCO2实测值和百分预计值均显著高于NS组(P<0.001), OUEP实测值和百分预计值显著低于NS组(P<0.001),提示AF患者的二氧化碳排出通气和摄氧通气有效性显著降低(表4)。
2.2.2 NS组、AF-NHF组与AF-HF组CPET核心指标结果的比较
为了明确AF患者合并心衰对其心肺整体功能的影响,将AF组患者按照是否合并心衰分为AF-NHF组和AF-HF组两个亚组,并与NS组进行组间比较(表5)。

AF- NHF 组的 peakVO2、AT、peakVO2/HR 实测值和百分预计值均显著低于NS组(P<0.01);OUEP实测值(P<0.01)和百分预计值(P<0.05)显著低于NS组;V
E/VCO2 slope和lowest VE/VCO2实测值均显著高于NS组(P<0.01),而百分预计值与NS组相比未见显著差异,提示尚未合并心衰的 AF 患者运动峰值时通气有效性异常可能首先表现为摄氧通气有效性的下降。
AF-HF 组的 peakVO2、AT、peakVO2/HR、OUEP实测值和百分预计值均显著低于NS组和AF-NHF组(P<0.01);AF- HF 组 的 lowest VE/VCO2、VE/VCO2 slope实测值和百分预计值均显著高于NS组和AF-NHF组(P<0.01),提示当AF患者合并心衰时其心肺整体功能、摄氧通气有效性和二氧化碳排出通气有效性均进一步显著下降。
2.3 NS组和AF组CPET静息、热身、AT、峰值和恢复期连续测定指标的变化及比较
本研究对NS组和AF组CPET各时期(静息、热身、AT、峰值和恢复期)的常用指标变化进行了比较(图1),并从系统生理学和整体整合生理学的角度分析AF患者的运动病理生理学特征。在常用CPET指标中,HR、SBP和DBP为循环指标,VE、VT和 RR 为呼吸指标,VO2、VO2/HR 和 SaO2为代谢指标。结果显示,SBP、DBP、HR、VE、VT、RR,VO2和VO2/HR在CPET各时期呈先缓后陡的上升趋势,并在恢复期快速下降;AF 组的上升趋势均低于正常组,下降比较缓慢;SaO2则呈几乎平直趋势。
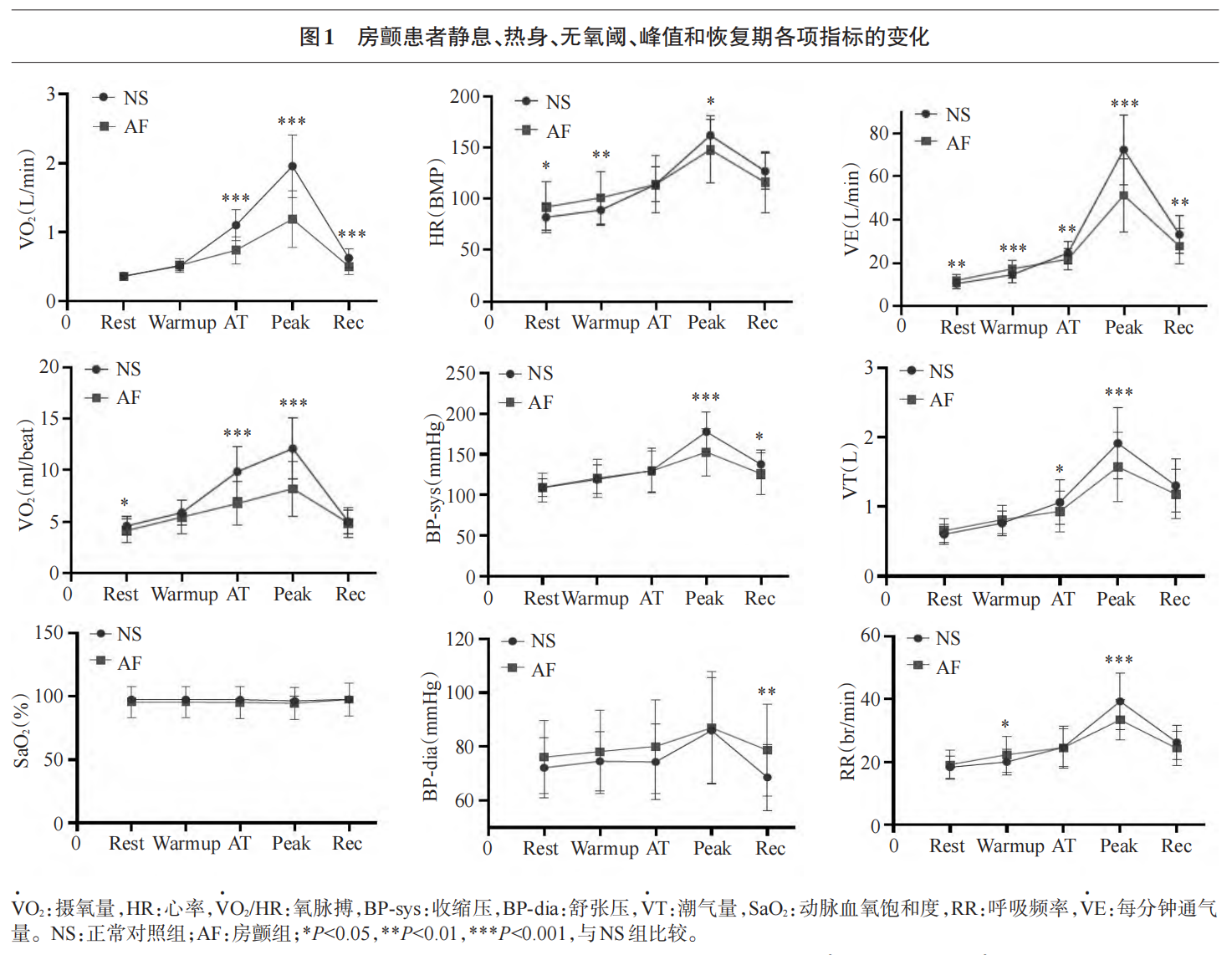
AF组静息和热身期VO2与NS组相比未见显著差异,AT、峰值和恢复期则显著低于 NS 组(P<0.001)。AF组的静息和热身期HR显著高于NS组(P<0.05—0.01),而 峰 值 时 显 著 低 于 NS 组(P<0.05);AT和恢复期无显著差异。AF组静息、AT和峰值期VO2/HR显著低于NS组(P<0.05—0.001),热身和恢复期无显著差异。AF组峰值和恢复期SBP显著低于 NS 组(P<0.05—0.001);DBP 恢复期时显著高于NS组(P<0.01)。
AF 组静息和热身期 VE 显著高于 NS 组(P<0.01—0.001),AT、峰值和恢复期显著低于NS组(P<0.01—0.001)。AF组热身期RR显著高于NS组(P<0.05),峰值时显著低于 NS 组(P<0.001),静息、AT和恢复期无显著性差异。AF组AT和峰值时VT显著低于NS组(P<0.05—0.001),静息、热身和恢复期无显著性差异
AF组和NS组的SaO2在5个不同功能状态时均为正常范围,且未见显著差异。
2.4 AF组患者单因素相关性分析
AF组peakVO2和AT百分预计值分别与心功能分级呈负相关(r=0.722,P<0.0001;r=﹣0.528,P<0.0001);AF组VE/VCO2 slope百分预计值与心功能呈正相关(r=0.581,P<0.0001)。
三、讨论
本研究证实AF患者整体心肺功能受限,表现为运动峰值时peakVO2、AT、VO2/HR和负荷功率下降;且摄氧通气有效性和CO2通气有效性均受限。AF患者未合并心衰时运动耐力、摄氧通气效率下降较正常人下降,但CO2通气效率尚无显著受损表现;AF合并心衰时,运动耐力、氧气和CO2通气有效性均受损加重。这些研究结果为加深对AF患者运动病理生理学的理解提供了一定的证据支持。
3.1 运动时AF和循环有效性
在过去的几十年中,一些侵入性和非侵入性血流动力学研究已经重点研究了心房收缩和正常窦性节律在维持充足心输出量,特别是在心衰患者运动中的作用。AF患者心输出量不足发生的机制包括心房收缩受损、心室节律紊乱伴随 HR 变异和心室充盈时间受损。每一种机制在需要调动最大收缩储备的峰值运动时都很重要。
3.1.1 房颤对运动中循环有效性的影响:本研究研究对象 AF 组包括尚未合并心衰的单纯 AF 患者和合并慢性心衰的 AF 患者。AF 组 peakVO2、AT、peakVO2/HR、peak SBP 实测值和百分预计值均显著低于NS组。目前关于单纯 AF 对心肺耐力的影响尚有争议。例如,有研究认为单纯AF是严重疾病状态,可导致运动耐力下降;而Atwood JE等的研究结果显示单纯AF并不引起心肺耐力下降。本研究中AF-NHF 组 peakVO2、AT、peakVO2/HR 较 NS 组均显著下降,百分预计值分别下降约 15.6%、15.5%和23.4%,peak SBP与NS组相比也显著下降(162.90±23.83mmHg:177.51±24.95mmHg),提示即使单纯AF也可使心肺耐力和有氧运动能力下降。此外,本研究中NS组患者年龄虽然显著低于AF-NHF组(体重和身高均无显著差异),但由于 peakVO2和 AT 百分预计值经过年龄、性别和体重等校正仍显著低值,说明AF对心肺功能具有重要的影响。其机制可能有:①与 AF 患者因心房正常收缩功能丧失和心室节律/率紊乱导致心输出量下降相关,具体体现在peakVO2/HR和SBP的下降;②与相关性症状导致的运动不耐受有关,具体表现为在症状限制最大极限运动试验中,AF-NHF组峰值负荷功率较NS组显著低值([ 142.85±32.49)W:(187.87±42.71)W,P<0.01)]。
此外,有研究显示伴有射血分数保留心衰(HFpEF)的AF组患者,运动峰值时VO2、VO2/HR和SBP较 窦 性 心 律 组 显 著 下 降 ,而 AT 则 无 显 著 性 改变。伴有射血分数下降心衰的AF组患者,peakVO2较窦性心律组下降10%—20%;VO2/HR(代表每博输出量)和 SBP 与窦性心律组相比有显著性降低,表明即使在心衰患者中,AF仍会对运动耐力产生不良影响。本研究并未将心衰非AF患者纳入研究对象,因此 AF 对心衰患者的心肺功能影响仍有待进一步研究。
3.1.2 合并心衰与否对运动中循环有效性的影响
本研究中AF-HF组的peakVO2、AT、peakVO2/HR实测值和百分预计值均显著低于 NS 组和 AF-NHF 组(P<0.01);单因素相关性分析结果显示,AF组患者的peakVO2和AT与心功能分级呈负相关(分别为:r=-0.722,P<0.0001和r=-0.528,P<0.0001)。这些结果与先行研究相一致,表明在慢性心衰患者,随着心功能的下降,peakVO2、AT和峰值负荷功率逐渐下降。
3.2 运动中AF和通气有效性
CPET的指标目前被认为是非侵入性检查中测定运动中气体交换和通气反应的“金标准”。VE/VCO2 slope 根据运动中所有 VE/VCO2数据由线性回归计算得出,是评价运动 CO2通气有效性指标。研究证实心衰患者VE/VCO2 slope与心血管事件的
预 后 密 切 相 关 ,在 预 测 意 义 上 甚 至 优 于 peakVO2 。但是VE/VCO2 slope在AF患者中的评估有效性仍存在争议,部分研究显示单纯 AF 患者表现出较高的VE/VCO2 slope,但另有研究显示两者并无相关性。前者是针对AF伴心衰患者心律转复治疗前后进行对比,研究对象主要为 LVED(64%±4%)和 NYHA 分级Ⅰ—Ⅱ级的轻症心衰患者;而后者则是对心衰患者(NYHA Ⅱ—Ⅲ级)中AF 组(LVEF 30.5% ± 10.4%)和非 AF 组(32.2% ±9.4%)进行比较。两研究结果的差异可能与研究对象的心功能障碍严重程度不同相关。此外,有研究显示 AF 患者 VE/VCO2 slope 与将来心脏事件的发生具有强相关性[。本研究显示,AF 组 VE/VCO2slope显著高于NS组(P<0.001),且与心功能分级呈正相关(r=0.581,P<0.0001)。
亚组分析中为了去除心衰对通气有效性的影响,我们对AF-NHF和NS组的VE/VCO2 slope进行了比较。结果显示AF-NHF组的VE/VCO2 slope的实测值较NS组有显著增高(P<0.01);百分预计值虽然有增高趋势,但较 NS 组均未见显著差异(P=0.058),提示可能需要进一步增加样本量以明确其和 AF 的关系。而 AF-HF 组患者的 VE/VCO2 slope的实测值和百分预计值显著高于NS组和AF-NHF组,提示CO2通气有效性下降可能和AF相关,且受心功能受损严重程度的影响。其机制可能和AF或心衰导致的心输出量下降,使肺生理学死腔增加,导致有氧和无氧代谢产物CO2的增加,从而影响了AF患者,特别是AF伴心衰患者的通气有效性。
OUEP 反映的是摄氧通气效率和肺血流/通气的匹配情况。在无明显通气限制的情况下,OUEP是判断血液循环有效性的最佳指标,用于预测心血管病患者存活和死亡的价值优于其他心血管病传统测定指标和心肺运动指标。目前尚未见针对AF对OUEP影响的相关报道。本研究显示AF组患者OUEP的实测值和百分预计值均比NS组有显著降低,提示AF患者摄氧通气效率下降。且AF-NHF组OUEP的实测值和百分预计值较NS均显著下降,提示在尚未合并心衰阶段,AF患者的摄氧量通气效率已经受损。其机制可能是因通气血流不匹配而引起运动中摄氧通气效率显著降低;且该变化随心功能的下降进一步下降。
3.3 运动中AF患者HR和SBP的反应
本研究中AF患者的静息和热身期HR偏快,显著高于 NS 组,但是峰值 HR 却显著低于 NS 组。既往大部分研究显示在心衰患者中 AF 组峰值 HR 较非AF组更高,这可能与心输出量下降和代偿性交感神经激活有关。也有研究显示峰值HR在伴有射血分数保留心衰的 AF和非AF 患者中并无显著差异。本研究显示AF组静息和热身期HR 较NS 组快,而峰值 HR 较 NS 组慢,说明 AF 组患者运动心率反应性下降。本结果与先行研究不同,其可能的原因有:①研究对象不同:本研究为AF患者和正常人进行比较,先行研究为心衰患者中的 AF 患者和非AF患者进行比较;②抑制心率药物应用比例不同:本研究中正常人群组未应用抑制心率药物,而AF组约66%的患者应用了心率抑制药物。先行研究中研究组和对照组心率抑制药物使用比例无显著差异。因此,本研究中 AF 组心率控制策略可能导致了运动心率反应性下降。本研究中运动HR反应性下降引起的心输出量相对下降可能是AF患者运动耐力下降的机制之一。正常人运动中血压升高,主要反映了心输出量增加和外周血管阻力一定程度上的增加。大部分研究显示心衰患者中 AF 可使峰值血压下降,并加重心房收缩障碍,但也有研究显示两者间并无相关性。我们的研究显示尽管AF组静息SBP与NS组 相 比 无 明 显 差 异 ,但 峰 值 SBP 较 NS 组 低 约15mmHg,且具有显著性差异。该结果和 AF 组peakVO2/HR显著下降均是运动中心脏收缩储备功能受损的表现。因本研究 AF 组包括 AF-NHF 和AF-HF,其中AF-NHF的峰值SBP较NS组有下降趋势,但无显著性差异;而AF-HF 较NS 组显著下降。因此,我们推测AF组峰值SBP下降机制如下:①AF的心室反应不规则导致的血流动力学损害,如心室节律不规则可使心输出量减少约 9%;②AF 组中心衰患者(占 AF 组总人数 71.3%)心功能的下降。此外,AF患者最大摄氧量受峰值SBP水平的影响,影响程度可达20%[17],提示峰值SBP低下可能是除心率反应性下降外导致AF患者运动耐力下降的另一机制。
3.4 通气循环相互影响的整理整合机制
整体整合生理学理论中提到:循环和呼吸功能是一体化调控,二者必须密切配合才能满足机体生命活动对O2的需要,并将代谢产生CO2送出体外,维持机体能量代谢和内环境的稳态。因此,O2和CO2是呼吸和循环调控的纽带。本研究显示AF可引起运动耐力和通气效率等整体心肺功能异常,其可能的机制为:①心房收缩功能在增加心输出量的作用中约占19%,心脏功能在AF患者中受损,心输出量下降,肌肉等外周组织的氧供下降。②AF患者末梢血流的间歇性变化可能影响血流剪切力介导的血管调控,导致运动中骨骼肌血流再分布受损,影响肌纤维能量代谢。③丧失了心房收缩促进心室充盈的功能,在心室舒张功能紊乱的情况下可能会使肺静脉压上升,促进肺间质水肿,使心脏储备功能受损在运动中更加显著,从而导致运动中通气血流比值不匹配。④AF使心室律/率紊乱,导致交感神经兴奋,反射性引起异常的心血管调控和神经失衡。此外,肌肉血流灌注不足、神经活性增加和亚临床肺间质水肿等也可
能影响运动的通气反应。运动中外周肌肉氧供不足可导致代谢产物CO2和H+增加,通过主动脉体和颈动脉体的体液途径,同时联合交感神经活性增加神经途径,共同调控呼吸反应,引起呼吸代偿。运动中机体的一系列代偿性反应,目的是为运动中的机体运动提供更充足的氧和能量物质,并迅速地排出代谢产物;同时,过度通气反应导致呼吸困难和乳酸堆积,引起肌肉疲劳,导致AF患者运动耐力下降。
四、本研究的局限性
本研究为单中心的回顾性研究。患者为在三级医院就诊并进行 CPET 检查的人群,不能代表普遍的包括社区或二级医院等大规模的 AF 人群。此外,本研究入组样本量较少,且存在个体差异,不同人之间无绝对可比性,可能存在统计学偏差,仅供参考。人体是一个不可分割的整体,各个器官系统之间紧密相连不可分割[34]。CPET检查是一项能够同时反映呼吸、循环和代谢的客观定量性检查,我们在整体整合生理学理论指导下通过运动CPET检查对AF患者的病理生理学进行探讨和分析,为AF患者的个体化客观定量评估奠定了理论基础。本课题组未来将继续加大样本量,对 AF 患者的病理生理学特征进行进一步研究,以求获得更加客观定量的统计学数据。
综上所述,AF 患者的 peakVO2、AT、VO2 /HR 等心肺整体功能指标和通气有效性显著受损,且受损的严重程度与是否合并心衰有关,提示 AF 患者应早期进行心肺耐力训练等干预措施,以期提高患者心肺功能,改善其生存质量。
参考文献:略
作者:戎荣[1]2]3]孙兴国[1]台文琦[1]王继楠[1周晴晴[1]陆晓[2][3]
作者单位:国家心血管病中心,中国医学科学院阜外医院,北京协和医学院心血管疾病国家重点实验室,心管疾病国家重点实验室[1]南京医科大学第一附属医院康复医学中心[2]南京医科大学康复医学院[3]
文章来源:中国康复医学杂志2022年第37卷第10期
声明:
1.本网站所有内容,凡是注明 “来源:心脏康复网”的文字、图片和音视频资料,授权转载时须请注明“来源:心脏康复网”。
2.本网所有转载文章系出于学术分享的目的,版权归原作者所有。如有侵权,请及时联系我们更改或删除。